Fåglar
Från Rilpedia
| ?Fåglar | |
|---|---|
 Olika fåglar
|
|
| Systematik | |
| Domän: | Eukaryoter Eukaryota |
| Rike: | Djur Animalia |
| Stam: | Ryggsträngsdjur Chordata |
| Understam: | Ryggradsdjur Vertebrata |
| Klass: | Fåglar Aves |
|
|
|
| §Aves | |
|
|
|
|
Överordning Paleognata fåglar (Paleognathae)
Överordning Neognata fåglar (Neognathae)
Utdöda ordningar
|
|
|
Hitta fler artiklar om djur med Djurportalen
|
|
Fåglar (Aves) är en klass tvåbenta, varmblodiga ryggradsdjur med näbb, vingar och fjädrar som lägger ägg. De flesta fåglar kan flyga, men inte alla. Det finns idag mellan 9 000 och 10 000 olika fågelarter i världen, beroende på hur man räknar, vilket gör dem till de mest skiftande landryggradsdjuren. De bebor ekosystem över hela jordklotet, från Arktis till Antarktis. Fåglar varierar i storlek från den 5 centimeter stora bikolibrin till den 2,7 meter stora strutsen. Fossilfynd tyder på att fåglarna utvecklades från dinosaurier under juraperioden, för omkring 150-200 miljoner år sedan, och den tidigaste kända fågeln är Archaeopteryx från yngre jura, för cirka 155–150 miljoner år sedan. De flesta paleontologer betraktar fåglarna som den enda kladen av dinosaurier som överlevde krita/tertiär-utdöendet för ungefär 65,5 miljoner år sedan.
Det som särskiljer fåglar från alla andra djur är deras fjäderdräkt. Karakteristiskt för nutida fåglar är dessutom att de har en näbb utan tänder, att de lägger ägg med hårda skal, har hög metabolism, ett hjärta med fyra kamrar, spolformade kroppar, och ett lättviktigt men starkt skelett. Alla fåglar har främre extremiteter som utvecklats till vingar och de flesta kan flyga, med några undantag, däribland strutsfåglar, pingviner, och ett antal olika endemiska arter på öar. Fåglarna har också unika matspjälknings- och respirationssystem som är mycket anpassade till flygning. Vissa fåglar, särskilt kråkfåglar och papegojor, är bland de mest intelligenta av djurarter. Ett antal fågelarter har observerats tillverka och använda verktyg, och många sociala arter uppvisar kulturell förmedling av kunskap över generationer.
Många arter genomför långdistansflyttningar, och många utför kortare oregelbundna rörelser. I normalfall räknar man med att en vuxen fågel energimässigt har tre årliga huvudposter: häckning, ruggning och flyttning. För stannfåglar är övervintring i kallt eller extremt torrt klimat en av huvudposterna istället för flyttningen.[1]Fåglar är sociala; de kommunicerar med användning av visuella signaler och genom sång, och deltar i sociala beteenden som kooperativ häckning och jakt, flockbildning, och mobbning mot predatorer. Det stora flertalet fågelarter är socialt monogama, vanligen för en häckningssäsong åt gången, ibland i åratal, men sällan för livet. Andra arter har häckningssystem som är polygyna ("många honor") eller, sällsynt, polyandriska ("många hanar"). Ägg läggs vanligen i ett rede och ruvas av föräldrarna. De flesta fåglar har en lång period efter kläckningen då föräldrarna tar hand om ungarna.
Många arter har ekonomisk betydelse, mestadels som källor till mat som utvinns genom jakt eller lantbruk. Vissa arter, särskilt sångfåglar och papegojor, är populära som sällskapsdjur. En annan användning är skörd av guano (spillning) för användning som gödsel. Fåglar har framträdande roller i alla aspekter av mänsklig kultur från religion till poesi till populärmusik. Omkring 120-130 arter har dött ut som en följd av mänsklig aktivitet sedan 1600-talet, och ytterligare hundratals innan dess. För närvarande är ungefär 1 200 fågelarter hotade av utrotning av mänsklig aktivitet, fastän det görs insatser för att skydda dem.
Innehåll |
Evolutionshistoria

Fåglar (Aves) är en monofyletisk grupp vars huvudlinjer utvecklades under den geologiska perioden jura, vilket innebär att de var samtida med dinosaurierna.
Den första klassificeringen av fåglar utvecklades av Francis Willughby och John Ray i deras verk Ornithologiae från 1676.[2] Carl von Linné modifierade det verket 1758 för att upprätta det taxonomiska klassificeringssystem som för närvarande används.[3] Fåglar kategoriseras som den biologiska klassen Aves i Linnés taxonomi. Inom fylogenetisk taxonomi placeras Aves i dinosauriekladen Theropoda.[4] Aves och en systergrupp, kladen Crocodilia (krokodildjur), är tillsammans de enda levande medlemmarna av reptilkladen Archosauria (härskarödlor). Fylogenetiskt definieras Aves vanligen som alla efterkommande till de senaste gemensamma förfadern till de nutida fåglarna och Archaeopteryx lithographica.[5] Archaeopteryx, från kimmeridgianstadiet av yngre jura (ungefär 155–150 miljoner år sedan), är den tidigaste kända fågeln enligt denna definition. Andra, däribland Jacques Gauthier och anhängare till PhyloCode-systemet, har definierat Aves så att det innehåller endast de moderna fågelgrupperna, och utesluter de flesta grupper som endast är kända från fossil. De senare förs istället till Avialae[6] delvis för att undvika osäkerheterna om placeringarna av Archaeopteryx i förhållande till djur som traditionellt anses som theropoddinosaurier.
Alla nutida fåglar ligger inom underklassen Neornithes, som har två underindelningar: paleognata fåglar (Paleognathae), som innehåller mestadels fåglar utan flygförmåga som strutsar, och den kraftigt skiftande neognata fåglar (Neognathae), som innehåller alla andra fåglar.[4] Dessa två underindelningar ges ofta rangen av överordning.[7] Beroende på taxonomiskt synsätt varierar antalet kända levande fågelarter från 9 800[8] till 10 050.[9]
Överlevande dinosaurier
Fossilfynd och intensiva biologiska analyser har demonstrerat bortom varje rimligt tvivel att fåglar är theropoddinosaurier och de flesta paleontologer är idag överens om att fåglar härstammar från köttätande dinosaurier, även om avgörande bevis tills vidare saknas. Fåglarna tillhör enligt dessa teorier en grupp coelurosaurier (en ordning köttätande dinosaurier) som kallas maniraptorer. Maniraptorer är en grupp theropoder som bland annat omfattar dromeosaurider och oviraptorider.[10] I Kina har man under 1990-talet och framåt funnit fossil av befjädrade dinosaurier. Med dessa fynd blir gränsen mellan dinosaurie och fågel allt mer otydlig. Fossila fynd i Liaoning-provinsen i nordöstra Kina, visar att många små theropoddinosaurier hade fjädrar vilket bidrar till denna tvetydighet.[11] 2003 publicerades även en artikel om en trädlevande dinosaurie med fyra vingar som man funnit fossil av i Kina.[12]
Den allmänna uppfattningen i samtida paleontologi är att fåglarna, Aves, är de närmaste släktingarna till deinonychosaurierna, som inbegriper dromeosaurider och troodontider. Tillsammans bildar dessa en grupp som kallas Paraves. Den basala dromeosauriden Microraptor har drag som kan ha gjort det möjligt för den att främst glidflyga. De mest basala deinonychosaurierna är mycket små och trädlevande. Detta indikerar möjligheten att förfadern till alla Paraves kan ha varit trädlevande, och/eller haft förmåga att glidflyga.[13][14]
Den närmaste mellanform mellan dessa dinosaurier och fåglar som man hittills funnit fossil av är Archaeopteryx från yngre jura, som är välkänd som en av de första felande länkar som dokumenterades och som gav stöd till evolutionsteorin i slutet av 1800-talet. Archaeopteryx har tydligt reptillika drag: tänder, fingrar med klor, och en lång ödlelik svans, men den har fint bevarade vingar med flygfjädrar, mycket lika dem hos nutida fåglar. Den anses inte vara en direkt förfader till dagens fåglar, men är den äldsta och mest primitiva medlemmen av Aves eller Avialae, och den är troligen närbesläktad med den verkliga förfadern. Det har till och med föreslagits att Archaeopteryx var en dinosaurie som inte var närmare besläktad med fåglar än andra dinosauriegrupper var,[15] och att det är mer troligt att Avimimus är förfader till alla fåglar än att Archaeopteryx är det.[16]
Om nämnda teorier om fåglarnas ursprung stämmer så är de i praktiken överlevande dinosaurier. Enligt det stora flertalet paleontologer som stödjer teorin att fåglarna utvecklats från köttätande dinosaurier är fåglarna (Aves) "avian dinosaurs", det vill säga "fågeldinosaurier" medan resten av deras utdöda släktingar är "non avian dinosaurs", det vill säga "icke fågeldinosaurier". Om det kommer ett slutgiltigt bevis på att fåglarna är något modifierade coelurosaurier så tycks de till skillnad från de andra dinosaurierna ha klarat massutdöendet för 65 miljoner år sedan utan större problem när en stor del av livet på jorden utplånades, inklusive alla "icke fågeldinosaurier".
Alternativa teorier och kontroverser
Det har varit många kontroverser i studiet av fåglarnas ursprung. Tidiga skiljaktigheter var bland annat om fåglar utvecklades från dinosaurier eller mer primitiva arkosaurier. Inom dinosaurielägret fanns åsiktsskillnader om huruvida ornithischier eller theropoder var de troligaste förfäderna bland dinosaurierna.[17] Fastän ornithischier (fågelhöftade dinosaurier) delar höftstrukturen med dagens fåglar, anses fåglar ha utvecklats från saurischier (ödlehöftade dinosaurier), och utvecklade därmed sin höftstruktur självständigt.[18] En fågelliknande höftstruktur utvecklades faktiskt en tredje gång bland en säregen grupp theropoder som kallas Therizinosauridae.
Vetenskapsmännen Larry Martin och Alan Feduccia anser att fåglar inte är dinosaurier, utan att fåglar utvecklades från tidiga arkosaurier som Longisquama. Merparten av deras publikationer hävdade att likheterna mellan fåglar och maniraptorer berodde på konvergent evolution och att de två är obesläktade. I slutet av 1990-talet blev bevisningen för att fåglar var maniraptorer nästan oemotsäglig, så Martin och Feduccia antog en modifierad version av en hypotes av dinosauriekonstnären Gregory S. Paul, där maniraptorer är sekundärt flygoförmögna fåglar men,[19] enligt deras version, utvecklades fåglar direkt från Longisquama. Därmed är fåglar fortfarande inte dinosaurier, och inte heller de arter som för närvarande klassificeras som theropoddinosaurier. Maniraptorer är istället flygoförmögna arkosauriska fåglar.[20] Denna teori bestrids av de flesta paleontologer.[21] De morfologiska drag som anförs som bevis för oförmåga att flyga tolkas av konventionella paleontologer som exaptationer, eller "för-anpassningar", som maniraptorer ärvde från sin och fåglarnas gemensamma förfader.
Protoavis texensis, beskrevs 1991 som en fågel äldre än Archaeopteryx. Kritiker har visat att fossilet är dåligt bevarat, i stor utsträckning rekonstruerat, och kan vara ett fantasidjur (tillverkat av en mycket tidig coelurosaurie).[22]
Fåglarnas tidiga evolution
| Aves |
|
||||||||||||||||||||||||
Fåglarna diversifierades till en stor mångfald former under kritperioden.[23] Många grupper behöll primitiva kännetecken, såsom kloförseddda vingar och tänder, även om de senare försvann oberoende av varandra i ett antal fågelgrupper, däribland Neornithes. Medan de tidigaste formerna, som Archaeopteryx och Jeholornis, behöll sina förfäders långa beniga stjärtar,[23] blev de mer framskridna fåglarnas stjärtar kortare när pygostylbenet framträdde i kladen Pygostylia.
Den första stora, mångfaldiga härstamning av kortstjärtade fåglar som utvecklades var Enantiornithes, eller "motsatta fåglar", som fått sitt namn eftersom uppbyggnaden av deras skulderben var tvärtemot den hos nutida fåglar. Enantiornithes intog en stor uppsättning ekologiska nischer, från sand-letande kustfåglar och fiskätare till trädlevande former och fröätare.[23] Mer framskridna härstamningar specialiserade sig också på att äta fisk, som den ytligt sett måsliknande underklassen Ichthyornithes ("fiskfåglar").[24] En ordning av mesozoiska havsfåglar, Hesperornithiformes, blev så väl anpassade till att jaga fisk i havsmiljöer att de förlorade flygförmågan och blev primärt vattenlevande. Trots deras extrema specialiseringar utgör Hesperornithiformes några av de närmaste släktingarna till nutida fåglar.[23]
De nutida fåglarnas radiation
Det är nu känt, på grund av upptäckten av Vegavis, att underklassen Neornithes, som innehåller alla nutida fåglar, utvecklades till några grundläggande härstamningslinjer vid slutet av kritaperioden[25] och är uppdelad på två överordningar, paleognata fåglar och neognata fåglar.
Paleognathae innehåller stubbstjärthönsen i Central- och Sydamerika och strutsfåglarna. De flygoförmögna strutsfåglarna (Struthioniformes) är den äldsta och därmed mest basala ordningen bland nu existerande fåglar. Denna klad separerade från övriga fåglar för över 100 miljoner år sedan. Nästa klad bland nu existerande fåglar att separera var Galloanserae, den överordning som innehåller hönsfåglarna och andfåglarna, vilket skedde för ungefär 95 miljoner år sedan. För cirka 75 miljoner år sedan började den tredje huvudgruppen, Neoaves utvecklas. Den omfattar i dag runt 95 procent av världens alla fågelarter. I och med massutdöendet av dinosaurier för omkring 65 miljoner år sedan så ser man hur fåglarna evolutionärt börjar utvecklas åt olika håll och en stor mängd familjer och släkten uppstod på kort tid. DNA-analyser visar på hur Neoaves splittrades i fyra klader där den första bland annat omfattar duvfåglar (Columbiformes), flamingoer (Phoenicopteriformes) och doppingfåglar. Nästa klad omfattar bland annat seglarfåglar (Apodiformes) och skärrfåglar (Caprimulgiformes). Den tredje kladen omfattar vadarfåglar (Charadriiformes), Pelikanfåglar, (Pelecaniformes), Stormfåglar (Procellariidae), lomfåglar (Gaviiformes) och pingvinfåglar (Sphenisciformes). Den fjärde kladen omfattar fåglar som återfinns på land och som ofta är trädlevande, exempelvis tättingar (Passeriformes), papegojfåglar (Psittaciformes) och falkartade rovfåglar (Falconiformes).
Tidpunkterna för söndringarna är mycket omdiskuterade bland forskare. Det råder enighet om att Neornithes utvecklades under kritperioden, och att söndringen mellan Galloanseri och de andra neognata fåglarna skedde före krita/tertiär-utdöendet, men det råder delade meningar om huruvida radiationen av de återstående neognata fåglarna skedde före eller efter de andra dinosauriernas utdöende.[26] Denna oenighet orsakas delvis av den avvikelse i data: molekylär datering tyder på radiation under krita, medan fossilfynd stöder en radiation under tertiär. Försöken att sammanjämka de molekylära och de fossila fynden har visat sig kontroversiella.[26][27]
Taxonomi

Fåglar (Aves) delas precis som alla andra organismer in i grupper som kallas ordningar. Ordningarna bland fåglar har ändelsen iformes i sitt vetenskapliga namn. Dessa ordningar delas sedan in i familjer som har ändelsen idae i sitt vetenskapliga namn. Familjen delas sedan upp i släkten som delas upp i arter som ibland delas upp i underarter. Underart är för vissa taxonomer synonymt med ras medan andra taxonomer bara använder begreppet ras om domesticerade djur, som tamhöns och dylikt. Läs mer om artbegreppet
Indelningarna av fåglar har tidigare baserats på anatomisk likhet. Med utgångspunkt i hur man ansett att ordningar varit släkt, och därmed hur de har bildats genom evolution, har man skapat ett klassificeringssystem - en taxonomi. Den listning av ordningar som ses till höger kallas för Clements-taxonomi. Med nya kunskaper om DNA har den klassiska taxonomin för fåglar ifrågasatts och det pågår världen över forskning på hur fåglar egentligen är släkt med varandra.
Klassificeringen av fåglarna är en tvistefråga. Ett nytt klassificeringssystem är exempelvis Sibley-Ahlquists taxonomi. Sibley och Ahlquists Phylogeny and Classification of Birds (1990) är en milstolpe i klassificeringen av fåglar,[28] fastän det ofta debatteras och ständigt revideras. De flesta fynden tycks antyda att hänförandet av ordningar är riktigt,[29] men forskarna är oeniga om förhållandena mellan själva ordningarna. Fynd från nutida fågelanatomi, fossil och DNA har alla tillämpats på problemet, men ingen stark enighet har framträtt. Mer nyligen ger nya fossila och molekylära fynd en alltmer klar bild av evolutionen av nutida fågelordningar. I både de nya uppläggen för fåglars taxonomi och i de klassiska kommer ordningen strutsfåglar (Struthioniformes) först eftersom man anser att denna ordning är den äldsta.
De allra flesta fåglar i Europa, och därmed Sverige, tillhör den största ordningen i världen, Passeriformes, det vill säga tättingar. Denna ordning utvecklades sent och är en av de sista ordningarna i både klassisk och modern taxonomi.
Kladogram över den evolutionära utvecklingen av fåglar[30]
.-------------- Strutsfåglar (Struthioniformes) & stubbstjärthöns (Tinamiformes)
Archaeopteryx —|
| .----------- Andfåglar (Anseriformes) & hönsfåglar ((Galliformes)
'--|
| .-- Duvfåglar (Columbiformes), flamingoer (Phoenicopteriformes), doppingfåglar (Podicipediformes), m.fl
| .-----|
| | '-- Seglarfåglar (Apodiformes), skärrfåglar (Caprimulgiformes), m.fl
'--|
| .----- Vadarfåglar (Charadriiformes)
| |
| | .-- Gökfåglar (Cuculiformes)
| |--|
| | '-- Lomfåglar (Gaviiformes), pingvinfåglar (Sphenisciformes), m.fl
'--|
| .-- Tättingar (Passeriformes), papegojfåglar (Psittaciformes), rovfåglar (Falconiformes)
'--|
'-- Övriga träd-, marklevande fåglar
Den globala fågelfaunans sammansättning och utbredning
Det finns idag ungefär 9 000 till 10 000 olika fågelarter i världen beroende på hur man kategoriserar en art (se artbegreppet). Fåglar lever och häckar i de flesta miljöer på jorden, på alla sju kontintenter och når sin allra sydligaste punkt, vad gäller häckningsutbredning, i ispetrellens kolonier som finns upp till 440 km inåt land i Antarktis.[32] Flera fågelfamiljer har också anpassat sig till ett liv på och i världshaven. Vissa havsfågelarter befinner sig på land enbart vid häckningstid[33] och vissa pingviner har observerats dyka upp till 300 meter.[34]
Många fågelarter har etablerat häckande populationer i områden dit de har introducerats av människor. Några av dessa introduktioner har varit avsiktliga. Exempelvis har fasan introducerats runtom i världen som viltfågel.[35] Andra har varit oavsiktliga, som etablerandet av vilda munkparakiter i flera nordamerikanska städer efter deras flykt från fångenskap.[36] Vissa arter, däribland kohäger[37] och rosenkakadua,[38] har spridit sig naturligt långt bortom sina ursprungliga utbredningsområden då jordbruksmetoder skapade lämpliga nya habitat.
Under ett längre tidsperspektiv minskar den totala mängden individer och även artantalet. Under de senaste årtusenden räknar man med att cirka en fjärdedel av det totala antal arter som existerade vid tidsrymdens början har försvunnit.[39] De områden i världen som har störst artrikedom i fråga om fåglar är tropikerna med länder som Colombia, Brasilien, Kamerun, Uganda, Indonesien och Nya Guinea medan exempelvis Nordamerika och Europa i jämförelse är artfattiga.[40]
I ett globalt perspektiv har den absoluta merparten av fågelarter små utbredningsområden och är få till antalet. I tropikerna är arter med små utbredningsområden och mindre populationer vanligare än norr om 40 eller 50 graders bredd där arternas genomsnittliga utbredningsområde ökar markant, samtidigt som artrikedomen minskar.
Anatomi och fysiologi
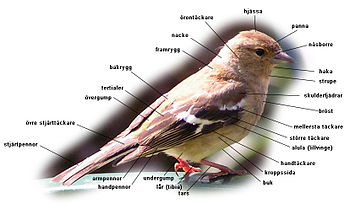
Se även artiklarna Fjäder, Ruggning och Fågeltopografi
Jämfört med andra ryggradsdjur har fåglarna en kroppsplan som uppvisar många ovanliga anpassningar, mestadels för att underlätta flygning.
Bland nu levande djur är det lätt att särskilja fåglar rent anatomiskt och det är inte flygförmågan utan fjäderdräkten som är deras mest typiska drag. Inga andra djur har fjädrar vilket alla fåglar har. Däremot kan inte alla fåglar flyga vilket många andra djur kan. Om man däremot ser till paleontologiska fynd av fossil så blir det genast svårare att särskilja fåglar från befjädrade dinosaurier. Dock har man inte funnit någon dinosaurie som har en fot konstruerad som fåglarnas, det vill säga med en bakåtriktad "stortå" som gör det möjligt för fågeln att gripa om trädgrenar och liknande. En annan anatomisk egenskap är fåglarnas sammanväxta svanskotor som bildar deras enda svansben.[41]
Fåglar är för övrigt jämnvarma äggläggare med vingar som är omvandlade framben. De flesta har en näbb utan tänder, spolformade kroppar, låg vikt och en snabb metabolism.
Några arter har förmåga att använda kemiska försvar mot predatorer; vissa Procellariiformes kan utstöta en obehaglig olja mot en angripare,[42] och några arter av pitohui från Nya Guinea utsöndrar ett kraftfullt neurotoxin i huden och fjädrarna.[43]
Fåglar har två kön: hane och hona. Fåglars kön bestäms av Z- och W-könskromosomer, istället för X- och Y-kromosomer som hos däggdjur. Hanarna bär två Z-kromosomer (ZZ), och honorna bär en W-kromosom och en Z-kromosom (WZ).[44] Hos nästan alla arter bestäms en individs kön vid befruktningen. En nyligen utförd studie visade dock temperaturberoende könsbestämning bland Alectura lathami, där högre temperaturer under ruvningen orsakade en högre andel honor gentemot hanar.[45]
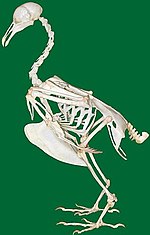
Skelett
Fåglars kroppar är lätta i förhållande till deras storlek och den största orsaken till detta är deras lätta skelett som ofta bara utgör cirka 10 procent av kroppsvikten. Bland annat har flera av benen och kraniet stora luftfyllda håligheter som har förbindelse med respirationssystemet.[46] Skallbenen är sammansmälta och kraniet har inga suturer.[44] Ögonhålorna är stora och åtskilda av en benvägg. Ryggraden har halsdel, bröstdel, länddel, bäckendel och bakparti. Antalet halskotor är mycket skiftande och särskilt flexibelt, men rörelsen är reducerad i de övre bröstkotorna och saknas i de senare ryggkotorna.[47] Till skillnad från de allra flesta ryggradsdjur har fåglar ett varierande antal halskotor. Det största antalet, tjugofem stycken, har svanar medan somliga papegojfåglar enbart har elva.[48] De sista ryggkotorna är sammanvuxna med bäckenet och bildar synsacrum.[44] Revbenen är tillplattade och bröstbenet är anpassat för att fästa flygmuskler, utom hos de flygoförmögna grupperna. Frambenen är modifierade till vingar.[49]
Hos duvor utgör skelettet endast 4,5 procent av kroppsvikten. Stabilitet skapas till exempel genom att flera av fågelns ben, bland annat några av ryggkotorna, samt nyckelben och höftben sammanvuxit och bildar något som kan liknas vid en inre rustning.
Matspjälkning
Hos fåglar, liksom hos reptiler, skiljer njurarna ut restprodukter från blodomloppet och utsöndrar det som urinsyra istället för urea eller ammoniak. Urinsyra utsöndras tillsammans med fekalier som halvfast spillning eftersom fåglar inte har separat urinblåsa eller urinrör.[50][51] Vissa fåglar, som kolibrier, kan dock utsöndra det mesta av de kvävehaltiga restprodukterna som ammoniak.[52] De utsöndrar också kreatin, snarare än kreatinin som däggdjur.[44] Detta material, liksom tarmarnas utsöndringar, kommer ut ur fågelns kloaköppning.[53][54] Kloaköppningen är en öppning som används till mycket: restprodukter lämnar kroppen genom den, fåglar parar sig genom att förena sina kloaköppningar, och honor lägger ägg genom den. Dessutom spyr många fågelarter upp spybollar.[55] Fåglarnas matspjälkningssystem är unikt, med en kräva för förvaring och en muskelmage som innehåller svalda stenar som används till att mala föda för att kompensera för frånvaron av tänder.[56] De flesta fåglar är mycket anpassade till snabb matspjälkning för att underlätta flygning.[57] Vissa flyttfåglar har dessutom förmåga att minska delar av inälvorna före flyttningen.[58]
Respirationssystem
Fåglarna har ett av de mest komplexa respirationssystemen av alla djurgrupper.[44] Efter inandning går 75% av den friska luften förbi lungorna och flödar direkt in i en lägre luftsäck som sträcker sig från lungorna och har förbindelse med luftfickor i benen, som fylls med luft. De övriga 25% av luften går direkt in i lungorna. När fågeln andas ut flödar den använda luften ut ur lungan och den sparade friska luften från den lägre luftsäcken tvingas samtidigt in i lungorna. Därmed får en fågels lungor ständigt tillgång till frisk luft under både inandning och utandning.[59] Fåglar framställer ljud genom användning av syrinx, en muskelkammare med flera trumhinnor som är belägen vid nedre änden av luftstrupen, varifrån den avskiljer sig.[60] Fågelns hjärta har fyra kammare och den högra aortabågen ger upphov till systemisk cirkulation (till skillnad från hos däggdjuren där den vänstra bågen är inblandad).[44] Undre hålvenen mottar blod från extremiteterna via renala portasystemet. Till skillnad från hos däggdjuren har de röda blodkropparna hos fåglarna en cellkärna.[61]
Reglering av kroppstemperatur
Alla fåglar har en kroppstemperatur på 40°C plus/minus 2°C. Precis som däggdjur har de en normal daglig fluktuation av sin kroppstemperatur på 1-2°C. Dagaktiva fåglar har sin temperaturtopp på dagen medan de nattaktiva har den på natten. Dessa cykler styrs av ljustillgången.
De flesta fåglar är endoterma, homeoterma och termoreglerande. Det vill säga de producerar sin egen värme, deras kroppar försöker hålla en jämn temperatur och deras kroppar reglerar den egna kroppstemperaturen. Däremot är många mindre fåglar heteroterma då de är endoterma, homeoterma och termoreglerande på dagen men poikiloterma och bradymetaboliska när de sover. Detta innebär att de under natten har en varierande temperatur och en mycket låg ämnesomsättning. Andra fåglar, exempelvis pingviner, är regionalt heteroterma då de har olika temperaturer i ben och vingar än i resten av kroppen. Blodkärl i ben och vingar fungerar som värmeväxlare som håller kvar värmen i kroppen och därmed blir benen och vingarna kalla. Fotens hudtemperatur hos en pingvin som står på isen kan vara 0°C.
Flygförmåga

De flesta fåglar kan flyga, vilket skiljer dem från nästan alla andra ryggradsdjur. Flygning är det främsta sättet att förflytta sig för de flesta fågelarter och används för häckning och födosök och för att undvika och fly från predatorer. Fåglarna har på olika sätt anpassat sig till flygning, bland annat med ett lättviktigt skelett, två stora flygmuskler och modifierade framben (vingar).[44] Vingens form och storlek bestämmer i allmänhet fågelns flygningstyp. Många fåglar kombinerar driven, flaxande flykt med mindre energiintensiv svävande flykt. Omkring 60 befintliga fågelarter saknar flygförmåga, liksom många utdöda fåglar.[62] Flygoförmåga uppstår ofta hos fåglar på isolerade öar, troligen på grund av begränsade resurser och frånvaro av landrovdjur.[63] Fastän de saknar flygförmåga använder pingviner liknande muskulatur och rörelser för att "flyga" genom vattnet, liksom alkor, liror och strömstarar.[64]
De flesta fåglars fysionomi är anpassade för flygning och de är därmed aerodynamiskt idealiska. Lyftkraften får fåglar genom en kombination av vingens form, precis som på ett flygplan, och genom att flaxa med vingarna. Fågelns vingrörelser alstrar en kraft som för den framåt men de alstrar också virvelströmmar, vorticitet, som lyfter fågeln. Vid låga hastigheter är det framför allt vingens rörelse nedåt som alstrar lyftkraft men ju högre hastighet fågeln har desto större lyftkraft alstras även vid den uppåtgående vingrörelsen. De fjädrar som driver fågeln framåt i flykten är vingpennorna. De kraftigaste musklerna hos fåglar är de som svarar för vingrörelserna och dessa muskler är fästade vid den stora bröstbenskammen. Till skillnad från hos exempelvis människor och hästar förekommer det inte någon fysiologisk förändring i rörelsemekanik när fågeln växlar från långsam till snabb rörelse, utan skeendet är kontinuerligt och utan någon abrupt förändring av muskelrörelser eller vingslagsmönster.
Nervsystem och sinnen
Nervsystemet är stort i förhållande till fågelns storlek.[44] Den mest utvecklade delen av hjärnan är den som styr de funktioner som har anknytning till flygning, medan lillhjärnan koordinerar rörelse och storhjärnan styr beteendemönster, navigation, parning och bobygge. De flesta fåglar har dåligt luktsinne, med nämnvärda undantag som kivier,[65] Nya världens gamar[66] och Procellariiformes.[67] Fåglars öron saknar ytteröra men är täckta av fjädrar, men hos vissa fåglar, såsom ugglor i släktena Asio, Bubo och Otus, bildar fjädrarna tofsar som ser ut som öron. Innerörat har en hörselsnäcka, men den är inte spiralformad som hos däggdjuren.[68]
Syn
Fåglarnas syn är vanligen välutvecklad. Sjöfåglar har speciella flexibla linser, som tillåter ackommodation för att se i luft och vatten.[44] Fåglar har till skillnad från däggdjur fyra typer av tappar i ögonen, vilket medför att de förutom blått, grönt och rött också kan se ultraviolett ljus.[69] Dock ser olika grupper av fåglar olika våglängder av UV-ljuset och exempelvis ser tättingar kortare våglängder än rovfåglar. Detta i sin tur medför att många mindre fåglar som för människan ser ut att ha en färgstark fjäderdräkt, som blåmes eller sidensvans, för en rovfågel eller kråkfågel ter sig i det närmaste "osynliga" eller perfekt kamouflerade gentemot naturen runt omkring.[70] Även för parningsleken är detta av betydelse. Många fåglar har fjäderdräktsmönster i ultraviolett som är osynliga för människans öga. Vissa fåglar vars kön förefaller likadana för en människas öga åtskiljs av närvaron av fläckar på fjädrarna som reflekterar ultraviolett ljus. Blåmeshanar har en fläck på hjässan som reflekterar ultraviolett och som visas upp vid parningsleken genom att de poserar och reser sina nackfjädrar.[71] Ultraviolett ljus används också vid födosök - falkar har observerats söka efter byte genom att avläsa de UV-reflekterande urinmärken som lämnas på marken av gnagare.[72] En fågels ögonlock används inte för att blinka. Istället fuktas ögat av blinkhinnan, ett tredje ögonlock som rör sig horisontellt.[73] Blinkhinnan täcker också ögat och fungerar som en kontaktlins hos många vattenfåglar.[44] Fågelns näthinna har ett solfjäderformat blodtillförselsystem som kallas Pecten oculi.[44] De flesta fåglar kan inte röra ögonen, men det finns undantag, såsom storskarven.[74] Fåglar med ögon på huvudets sidor har ett vidsträckt synfält, medan fåglar med ögon på framsidan av huvudet, såsom ugglor, har binokulärt seende och uppfattar skärpedjup.[75]
Generellt kan man säga att ju tätare tapparna sitter i ögat desto skarpare syn. Den plats i ögat där tapparna är som mest koncentrerade är fovean. Till skillnad från de flesta däggdjur (inklusive människan) som har en fovea i varje öga, har många fåglar istället två som även innehåller en mycket hög koncentration av tappceller och som därmed ger dem en mycket detaljcentrerad syn.
Många rovfåglar kan dessutom använda fördjupningen i fovea som ett teleobjektiv till en kamera och zooma in blicken och på så vis urskilja detaljer på större avstånd.[76]
Sömn
Det finns stora likheter mellan sömn hos fåglar och sömn hos däggdjur,[77] vilket är en av anledningarna till att man tänker sig att sömnen hos högre djur med dess uppdelning i REM- och icke-REM-sömn, har utvecklats evolutionärt tillsammans med varmblodighet.[78] En egenhet som dock skiljer dem från landlevande däggdjur men som de delar med exempelvis vattenlevande däggdjur är förmågan till så kallad unihemisfärisk sömn, det vill säga förmågan att sova med en hjärnhalva i taget medan den andra är vaken.[79]
Fjädrar och fjäderdräkt

Fjädrar är ett drag som är unikt för fåglar. De underlättar flygning, ger isolering som hjälper till vid termoreglering, och används för uppvisning, kamouflage och signalering.[44] Det finns flera typer av fjädrar, som var och en tjänar sin egen uppsättning syften. Fjädrar är utväxter från överhuden som sitter fast i huden och endast uppstår i specifika hudområden. Mönstret för dessa fjäderområdens fördelning används i taxonomi och systematik. Fjädrarnas ordning och utseende på kroppen, fjäderdräkten, kan variera inom arter efter ålder, social status[80] och kön.[81]
Fjäderdräkten ruggas regelbundet. De flesta arter ruggar årligen, men vissa kan ha två ruggningar om året, och stora rovfåglar kan rugga bara en gång på flera år. Ruggningens mönster varierar mellan arter. Vissa tappar och återväxer vingens flygfjädrar, börjar i sekvens från de yttersta fjädrarna och fortsätter inåt (centripetalt), medan andra ersätter fjädrar med början från de innersta (centrifugalt). Ett litet antal arter, såsom änder och gäss, tappar alla flygfjädrar på en gång och blir tillfälligt utan flygförmåga.[82] Centripetala ruggningar av stjärtfjädrar ses exempelvis hos fälthöns.[83] Centrifugal ruggning förekommer, exempelvis, i stjärtfjädrarna hos hackspettar och trädkrypare, fastän det börjar med det näst innersta paret stjärtfjädrar och slutar med det centrala fjäderparet så att fågeln behåller en funktionell stjärt för klättring.[84] Det allmänna mönstret hos tättingar är att handpennorna ersätts utåt, armpennorna inåt, och stjärten utåt från mitten.[85] Innan de bygger bo får honorna i de flesta arter en naken ruvfläck genom att de förlorar fjädrar nära buken. Huden där är väl utrustad med blodkärl och hjälper fågeln under ruvningen.[86]
Fjädrar kräver underhåll och fåglar putsar eller ansar dem dagligen. De ägnar i genomsnitt 9% av dagen åt detta.[87] Näbben används för att borsta bort främmande partiklar och applicera vaxutsöndringar från uropygialkörteln. Dessa utsöndringar skyddar fjädrarnas flexibilitet och hämmar tillväxten av bakterier som bryter ned fjädrarna.[88] Detta kan kompletteras med utsöndringar av myrsyra från myror, vilket fåglar upptar genom ett beteende som kallas myrning, för att få bort fjäderparasiter.[89]
Fjäll
Fåglars fjäll består av samma keratin som näbbar, klor och sporrar. De återfinns främst på tårna och mellanfoten, men kan befinna sig högre upp på vristen hos vissa fåglar. De flesta fågelfjäll överlappar inte påtagligt, utom hos kungsfiskare och hackspettar.
Fågelembryon börjar sin utveckling med len hud. På fötterna kan hudens yttersta lager, hornlagret, keratiniseras, tjockna och bilda fjäll.
Fjädrar kan blandas med fjäll på vissa fåglars fötter. Fjädersäckar kan ligga mellan fjäll eller till och med direkt under dem, i det djupare hudlagret läderhuden. I detta sista fall kan fjädrar framträda direkt genom fjäll och omringas helt av fjällets keratin.[90]
Beteende
De flesta fåglar är dagaktiva, men vissa fåglar, som många ugglearter och nattskärror, är nattaktiva eller skymnings- och gryningsaktiva, och många kustvadare födosöker när tidvattnet är lämpligt, på dagen eller natten.[91]
Föda och födosök
Bland fågelarterna finns många olika födoämnesspecialiseringar representerade. De kan till exempel äta nektar, frukt, hela växter, frön, as, och små djur (även andra fåglar).[44] Eftersom fåglar inte har tänder är deras matsmältningssystem anpassat för att bearbeta otuggad föda som svalts hel.
Fåglar som har många olika sätt att skaffa sig mat och äter många olika sorters mat kallas generalister. Andra koncentrerar sina födosökningsansträngningar på speciella födoämnen och har speciella metoder att få tag i dessa. De kallas specialister.[44]Många arter samlar små munsbitar, till exempel insekter, ryggradslösa djur, frön eller frukter. En del jagar insekter genom att plötsligt attackera dem från en trädgren.
Nektarätare såsom kolibrier, solfåglar, loripapegojor bland andra har särskilt anpassade borstiga tungor och i många fall näbbar utformade för att passa medanpassade blommor.[92] Kivier och vadare med långa näbbar söker efter ryggradslösa djur; vadares varierande näbblängder och födosöksmetoder får följden att ekologiska nischer åtskiljs.[44][93] Lommar, dykänder, pingviner och alkor jagar sitt byte under vattnet med vingar eller fötter som hjälp för att ta sig fram,[33] medan luftburna predatorer såsom sulor, kungsfiskare och tärnor störtdyker efter sitt byte. Flamingoer, tre arter av valfåglar och vissa änder är filtrerare.[94][95] Gäss och änder är i första hand gräsätare. Vissa arter, däribland fregattfåglar, måsar och trutar[96] och labbar,[97] ägnar sig åt kleptoparasitism, stjäl föda från andra fåglar. Kleptoparasitism tros vara ett supplement till föda som fås genom jakt, snarare än en betydande del av någon arts föda; en studie av större fregattfåglar som stal från masksulor uppskattade att fregattfåglarna stal högst 40% av sin föda och i genomsnitt stal bara 5%.[98] Andra fåglar är asätare; vissa av dessa, som gamar, är specialiserade på att äta as, medan andra, som måsar och trutar, kråkfåglar, eller andra rovfåglar, är opportunister.[99]
Flyttning
Många fågelarter flyttar för att dra fördel av globala skillnader i årstidstemperaturer och få så god tillgång till födokällor och häckningsområden som möjligt. Flyttningarna varierar bland de olika grupperna. Många landfåglar, kustfåglar och vattenfåglar genomför årliga långdistansflyttningar, som vanligen utlöses av dagsljusets längd samt väderförhållanden. Dessa fåglar kännetecknas av att de tillbringar häckningssäsongen i de tempererade eller arktiska-antarktiska områdena och en icke-häckningssäsong i de tropiska områdena eller motsatta halvklotet. Före flyttningen ökar fåglarna kroppsfetter och reserver betydligt och minskar storleken på en del av sina organ.[100][58] Flyttningen kräver stora mängder energi, särskilt då fåglar behöver korsa öknar och hav utan att tanka. Landfåglar kan flyga runt 2500 km och kustfåglar kan flyga upp till 4000 km,[44] men myrspoven kan flyga utan uppehåll upp till 10 200 km.[101] Havsfåglar genomför också långa flyttningar. Den längsta årliga flyttningen är grålirans. Gråliror bygger bo i Nya Zeeland och Chile och tillbringar den nordliga sommaren på födosök i norra Stilla havet utanför Japan, Alaska och Kalifornien, en årlig rundtur på 64 000 km.[102] Andra havsfåglar skingras efter häckning, färdas långt men har ingen bestämd flyttningsrutt. Albatrosser som bygger bo i Antarktiska oceanen genomför ofta cirkumpolära resor mellan häckningssäsonger.[103]
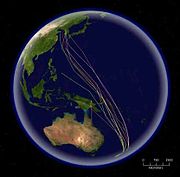
Vissa fågelarter genomför kortare flyttningar, där de bara färdas så långt som krävs för att undvika dåligt väder eller skaffa mat. Invasionsarter såsom de nordliga finkarna är en sådan grupp och kan vanligen hittas på en plats ett år och saknas nästa år. Denna typ av flyttning förknippas vanligen med tillgång på mat.[104] Arter kan också förflytta sig kortare distanser över delar av sitt utbredningsområde, då individer från högre latituder flyttar in i artfrändernas etablerade utbredningsområde. Andra genomför partiella flyttningar, där bara en liten del av populationen, vanligen honor och underdominanta hanar, flyttar.[105] Partiell flyttning kan bilda en stor andel av flyttningsbeteendet för fåglar i vissa regioner. I Australien visade undersökningar att 44% av icke-tättingar och 32% av tättingar var partiella flyttfåglar.[106] Altitudinell flyttning är en form av kortdistansflyttning där fåglar tillbringar häckningssäsongen på högre höjder och flyttar till lägre höjder under suboptimala förhållanden. Det utlöses oftast av temperaturförändringar och sker vanligen när de normala reviren också blir ogästvänliga på grund av brist på föda.[107] Vissa arter kan också vara nomadiska. De har då inget bestämt revir och flyttar efter väder och tillgång på föda. Äkta papegojor som familj är varken flyttfåglar eller stannfåglar utan anses antingen vara spridningsflyttare, invasionsflyttare, nomadiska eller genomföra små och oregelbundna flyttningar.[108]
Fåglars förmåga att återvända till exakta platser över stora avstånd har varit känd en längre tid. I ett experiment som utfördes på 1950-talet återvände en mindre lira som släppts i Boston till sin koloni i Skomer i Wales inom 13 dagar över ett avstånd på 5 150 km.[109] Fåglar navigerar under flyttningen med hjälp av en mångfald metoder. För dagaktiva flyttfåglar används solen för att flytta på dagen, och en stjärnkompass på natten. Fåglar som använder solen kompenserar för solens föränderliga position genom att använda en inre klocka.[44] Orientering med stjärnkompass beror på hur stjärnbilderna runt Polstjärnan står.[110] Dessa backas upp hos några arter av deras förmåga att förnimma jordens magnetfält genom specialiserade fotoreceptorer.[111]
Vila och sömn
Fåglarnas höga nivåer av metabolism under dygnets aktiva timmar kompletteras av vila vid andra tidpunkter. Sovande fåglar använder ofta en sorts sömn som kallas vaksam sömn, där perioder av vila omväxlar med snabba "tittar" då fågeln snabbt öppnar ögonen, vilket gör det möjligt för dem att vara känsliga för störningar och tillåter snabb flykt från hot.[112] Det har i stor utsträckning ansetts att seglare kan sova medan de flyger, men detta har inte bekräftats experimentellt. Det kan dock finnas vissa former av sömn som är möjliga även under flygning.[113] Vissa fåglar har också demonstrerat förmåga att falla i djupsömn med hjärnhalva åt gången. Fåglarna tenderar att utöva denna förmåga beroende på position i förhållanden till utsidan av flocken. Detta kan tillåta ögat som är motsatt den sovande hjärnhalvan att fortsätta att hålla utkik efter predatorer genom att betrakta flockens yttre delar. Denna adaption har också observerats hos marina däggdjur.[114] Gemensam sömn är vanlig eftersom den sänker förlusten av kroppsvärme och minskar de risker som förknippas med predatorer.[115] Sovplatserna väljs ofta ut med tanke på termoreglering och säkerhet.[116]
Många sovande fåglar böjer huvudet över ryggen och stoppar in näbben i ryggfjädrarna, men andra placerar näbben bland bröstfjädrarna. Många fåglar vilar på ett ben, medan andra kan dra upp benen i fjädrarna, särskilt vid kallt väder. Fåglar som sitter på grenar har en senlåsande mekanism som hjälper dem att hålla sig kvar på grenen när de sover. Många marklevande fåglar, som vaktlar och fasaner, sover i träd. Några få papegojor av släktet Loriculus sover hängande upp och ned.[117] Vissa kolibrier faller i dvala på natten och nivåerna för deras ämnesomsättning sjunker.[118] Denna fysiologiska adaption finns även hos nästan hundra andra arter, däribland uggleskärror och nattskärror. En art, dvalnattskärran, faller till och med i vinterdvala.[119] Fåglar har inga svettkörtlar, men de kan kyla ned sig genom att flytta till skuggan, ställa sig i vatten, flämta, öka sin ytarea, fladdra med halsen eller använda andra särskilda beteenden.
Kommunikation

Fåglar kommunicerar med främst synliga och hörbara signaler. Signalerna kan användas mellan arter eller inom arter.
Fåglar använder ibland fjäderdräkten för att avgöra och hävda social dominans,[120] för att visa upp häckningskondition i arter med sexuellt urval, eller för att göra hotande uppvisningar, som solrallens härmning av ett stort rovdjur för att avvärja hökar och skydda ungfåglar.[121] Variationen i fjäderdräkt tillåter också identifiering av fåglar, särskilt urskillning av olika arter. Den visuella kommunikationen bland fåglar kan också inbegripa ritualiserade uppvisningar, som har utvecklats från icke-signalerande handlingar som putsning, justering av fjäderposition, hackande och andra beteenden. Dessa uppvisningar kan signalera aggression eller undergivenhet eller kan bidra till att bilda parband.[44] De mest utarbetade uppvisningarna sker under parningsleken, där "danser" ofta bildas av komplexa kombinationer av många möjliga ingående rörelser.[122] Hanarnas häckningsframgång kan bero på kvaliteten i sådana uppvisningar.[123]
Fågelläten
Fåglar kan åstadkomma en mängd olika ljud, för en mängd olika syften, däribland att locka till sig en partner,[44] utvärdera potentiella partner,[124] bilda samhörighetsband, göra anspråk på och behålla revir,[44] identifiera andra individer (såsom när föräldrar letar efter ungar i kolonier eller när partner återförenas vid början av häckningssäsongen),[125] varna andra fåglar för potentiella predatorer, ibland med specifik information om hotets natur,[126] och ge respons på individer av samma art.
Det är framför allt de sjungande och visslande läten som fåglar, främst tättingar, åstadkommer som vi brukar förknippa med fågelläten. Dessa läten bildas i syrinx och är den främsta metoden med vilken fåglar kommunicerar med ljud. Lätena delas in i olika kategorier som sång, lockläte, varningsläte, skuggsång och tiggläte. De olika lätena används av fågeln vid olika tillfällen och i olika perioder i fågelns liv. Många arter har en stor repertoar av läten medan andra arter är i det närmaste stumma.
Denna kommunikation kan vara mycket komplex. Vissa arter kan hålla igång båda sidorna av syrinx oberoende av varandra, vilket tillåter att två olika sånger framförs samtidigt.[60]
Vissa fåglar använder även mekaniska ljud för att kommunicera. Coenocorypha-beckasinerna i Nya Zeeland framdriver luft genom sina fjädrar,[127] hackspettar trummar för att hävda revir,[57] palmkakaduor använder verktyg för att trumma,[128] storken klapprar med näbben och enkelbeckasinen åstadkommer ett vinande läte med hjälp av sina stjärtfjädrar när den störtdyker vid spelflykt.
Flockbildning och andra sammanslutningar

Medan vissa fåglar i huvudsak är revirbundna eller lever i små familjegrupper, kan andra fåglar bilda stora flockar. De främsta fördelarna med flockbildning är säkerheten i större antal och ökad effektivitet vid födosök.[44] Försvar mot predatorer är särskilt viktigt i slutna miljöer som skogar, där överfallspredation är vanligt och många ögon kan ge ett värdefullt system för tidig varning. Detta har lett till utvecklingen av många flockar med olika arter som födosöker tillsammans. Dessa består vanligen av många arter i små antal och ger säkerhet i större antal samtidigt som det minskar potentiell konkurrens om resurser.[130] Bland nackdelarna med flockbildning finns att socialt underordnade fåglar utsätts för mobbning av mer dominanta fåglar och i vissa fall minskad effektivitet vid födosök.[131]
Fåglar bildar ibland också sammanslutningar med icke-fåglar. Störtdykande havsfåglar samarbetar med delfiner och tonfisk, som driver stimmande fiskar mot ytan.[132] Näshornsfåglar har en mutualistisk relation med Helogale-manguster, där de födosöker tillsammans och varnar varandra för rovfåglar och andra predatorer i närheten.[133]
Häckningsprocess
Fåglarnas reproduktionsperiod, från parningsspel och parning till dess att ungarna kan lämna boet, kallas häckning. De flesta arter skapar ett revir som de försvarar på olika vis. Vissa fåglar häckar i kolonier och andra enskilt. Många fåglar bygger ett rede som kan vara allt ifrån en grund urgröpning i marken till enorma risbon. Parningen sker oftast på en gren eller på marken. Dock parar sig de flesta andfåglar i vattnet och seglare parar sig i luften. Parningen sker oftast genom att hanen och honans kloak möts för att sperma ska överföras. Vissa fåglar har så kallad omvänd könsordning och andra arter har ett polyandriskt parningssystem. Hos de flesta arter tar båda föräldrarna hand om ruvningen. Vissa arter, exempelvis göken, är så kallade häckningsparasiter, vilket innebär att arten lägger sitt ägg i någon annan arts bo och överlåter ruvning och uppfödning helt åt en annan fågel. De flesta fåglar lägger flera ägg, vanligtvis ett om dagen. Ruvningstiden tar allt från tättingarnas 10 dagar till albatrossens 80 dagar. Kläckningsprocessen tar allt från några minuter till de stora albatrossarna som kan ta uppemot fyra timmar att kläckas. Fåglar brukar grovt delas in i grupperna borymmare, bostannare och intermediära.
Sociala system

Nittiofem procent av världens fågelarter är socialt monogama, det vill säga lever socialt som par om än inte sexuellt. Dessa arter bildar par för åtminstone hela häckningssäsongen eller - i vissa fall - i flera år eller tills en av partnerna dör.[135] Monogami möjliggör omvårdnad från båda föräldrar, vilket är särskilt viktigt för arter där honor behöver hanars hjälp för att framgångsrikt föda upp ungarna.[136] Bland många socialt monogama arter är kopulation utanför paret (otrohet) vanligt.[137] Sådant beteende sker vanligen mellan dominanta hanar och honor i par med underordnade hanar, men kan också vara en följd av tvångskopulation hos änder och andra egentliga andfåglar.[138] För honor är möjliga fördelar av kopulation utanför paret att få bättre gener till sin avkomma och att försäkra sig mot möjlig infertilitet hos partnern.[139] Hanar av arter som ägnar sig åt kopulationer utanför parbildningen bevakar sina partner närgånget för att försäkra sig om föräldraskapet till den avkomma som de föder upp.[140]
Andra häckningssystem, däribland polygyni, polyandri, polygami, polygynandri och promiskuitet, förekommer också.[44] Polygama häckningssystem uppstår när honor kan uppföda ungar utan hjälp från hanar.[44] Vissa arter kan använda mer än ett system beroende på omständigheterna.
Häckningen inbegriper vanligtvis någon sorts parningslek, som oftast utförs av hanen.[141] De flesta uppvisningar är ganska enkla och innehåller någon sorts sång. Vissa uppvisningar är dock ganska utarbetade. Beroende på art kan dessa omfatta trumning med vinge eller stjärt, dans, flyguppvisningar eller gemensam lek. Honorna är vanligen de som driver partnervalet,[142] men hos de polyandriska simsnäpporna är detta omvänt: mer enkelt färgade hanar väljer bjärt färgade honor.[143] Partnerna genomför vanligen matning, näbbkontakt och putsning med varandra, i allmänhet efter att fåglarna har bildat par och kopulerat.[57]
Revir, bobygge och ruvning
Många fåglar försvarar aktivt ett revir från andra av samma art under häckningssäsongen. Att upprätthålla reviret försvarar födokällan för deras ungar. Arter som saknar förmåga att försvara födorevir såsom havsfåglar och seglare, häckar ofta i kolonier istället. Detta anses erbjuda skydd från predatorer. Kolonihäckare försvarar små boplatser och konkurrensen mellan och inom arter för boplatser kan vara intensiv.[144]

Alla fåglar lägger amniotiska ägg med hårda skal som mestadels består av kalciumkarbonat.[44] Arter som häckar i hålor tenderar att lägga vita eller bleka ägg, medan arter med öppna bon lägger kamouflerade ägg. Det finns dock många undantag från detta mönster; de markhäckande nattskärrorna har bleka ägg, och ger istället kamouflage med sin fjäderdräkt. Arter som är offer för häckningsparasiter har varierande äggfärger för att förbättra chanserna att upptäcka en parasits ägg, vilket tvingar honor av parasiter att anpassa sina ägg till värddjurens.[145]
Fågelägg läggs vanligen i ett rede. De flesta arter skapar ganska utarbetade reden, som kan vara skålformiga, kupolformiga, platta, gropar, högar eller hålor.[146] Vissa fågelbon är dock extremt primitiva; albatrossbon är inte mer än en grund fördjupning i marken. De flesta fåglar bygger bon i skyddade, gömda områden för att undvika predation, men stora eller kolonihäckande fåglar - som har större försvarsförmåga - kan bygga mer öppna bon. Under bobygget letar vissa arter upp växtmaterial från växter med parasitbegränsande gifter för att förbättra ungarnas överlevnad,[147] och fjädrar används ofta för att isolera boet.[146] Vissa fågelarter har inga bon: den klipphäckande sillgrisslan lägger sina ägg på bar klippa, och kejsarpingvinhanar håller ägg mellan kroppen och fötterna. Frånvaro av bon är särskilt vanligt hos markhäckande arter där de nykläckta ungarna är borymmare.
Ruvningen, som optimerar temperaturen för ungarnas utveckling, börjar vanligen efter att det sista ägget har lagts.[44] Hos monogama arter delas ofta ruvningen mellan föräldrarna, medan ofta en förälder är helt ansvarig för ruvningen hos polygama arter. Värmen från föräldrarna passerar till äggen genom ruvfläckar, områden med naken hud på buken eller bröstet på de ruvande fåglarna. Ruvning kan vara en energikrävande process. Adulta albatrosser, till exempel, förlorar så mycket som 83 gram av sin kroppsvikt per dag under ruvningen.[148] Värmen för ruvningen av ägg hos storfothöns kommer från solen, ruttnande vegetation eller vulkaniska källor.[149] Ruvningsperioderna varierar från 10 dagar (hos hackspettar, gökar och tättingar) till över 80 dagar (hos albatrosser och kivier).[44]
Föräldrarnas omvårdnad
Vid tiden för kläckningen varierar ungarna i utveckling från hjälplös till självständig, beroende på art. Hjälplösa ungar kallas "bostannare", och tenderar att födas små, blinda, orörliga och nakna. Ungar som föds rörliga och befjädrade kallas "borymmare". Bostannare behöver hjälp med termoreglering och måste ruvas längre tid än borymmare. Ungar som ligger mellan dessa ytterligheter kallas intermediära.
Längden och karaktären av föräldrarnas omvårdnad varierar kraftigt mellan olika ordningar och arter. En ytterlighet är storfothöns, där föräldrarnas omvårdnad tar slut när äggen kläcks. Den nykläckta ungen gräver ut sig själv från boet utan hjälp från föräldrarna och kan klara sig själv omedelbart.[150] Vid den andra ytterligheten finns många havsfåglar som har långa perioder av omvårdnad från föräldrarna. Den längsta finns hos större fregattfågel, vars ungar tar upp till sex månader för att bli flygga och uppföds av föräldrarna i ytterligare upp till 14 månader.[151]

Hos vissa arter tar båda föräldrar hand om boungar och flygga ungar, medan hos andra bara det ena könet sköter detta. Hos vissa arter hjälper andra medlemmar av samma art – vanligen nära släktingar till det häckande paret, såsom avkomma från tidigare kullar – till med att föda upp ungarna.[152] Detta beteende är särskilt vanligt bland Corvida, som omfattar fåglar som kråkfåglar, flöjtfågel och Malurus,[153] men har observerats hos så olika arter som Acanthisitta chloris och röd glada. Bland de flesta grupper av djur är det ovanligt att hanen sköter om ungarna. Hos fåglar är det däremot ganska vanligt – mer än hos någon annan klass av ryggradsdjur.[44] Fastän försvaret av revir och boplats, ruvning och uppfödning av ungar ofta är delade uppgifter, finns det ibland en arbetsdelning där en partner utför allt eller det mesta av en viss uppgift.[154]
Tidpunkten då ungarna blir flygga varierar dramatiskt. Ungarna hos Synthliboramphus, såsom kragalka, lämnar boet natten efter att de kläckts och följer sina föräldrar ut till havs, där de uppfostras utom räckhåll för landlevande predatorer.[155] Vissa andra arter, såsom änder, flyttar sina ungar bort från boet vid tidig ålder. Hos de flesta arter lämnar ungarna boet precis innan, eller strax efter, de har fått flygförmåga. Mängden omvårdnad från föräldrarna efter att ungarna blivit flygfärdiga varierar. Albatrossungar lämnar boet på egen hand och får ingen ytterligare hjälp, medan andra arter fortsätter att ge kompletterande utfodring efter att ungarna blivit flygga.[156] Ungarna kan också åtfölja sina föräldrar under sin första flyttning.[157]
Häckningsparasiter
Häckningsparasitism, där en äggläggare lämnar sina ägg i en annan individs kull, är vanligare bland fåglar än hos någon annan sorts organism.[158] Efter att en parasitisk fågel lagt sina ägg i en annan fågels rede accepteras de ofta och föds upp av värddjuret på bekostnad av värdens egen kull. Häckningsparasiter kan vara antingen obligata häckningsparasiter, som måste lägga sina ägg i andra arters reden eftersom de är oförmögna att föda upp sina egna ungar, eller icke-obligata häckningsparasiter, som ibland lägger ägg i artfränders bon för att öka mängden avkomma fastän de kunde ha fött upp sina egna ungar.[159] Etthundra fågelarter, däribland arter av honungsgökar, trupialer, astrilder och andfåglar, är obligata parasiter, men de mest kända är gökarna.[158] Vissa häckningsparasiter är anpassade för att kläckas före värdfågelns ungar, vilket låter dem förstöra värdens ägg genom att knuffa ut dem från boet eller döda värdens ungar. Detta försäkrar att all föda som tas till boet kommer att ges till parasitungarna.[160]
Ekologi
Fåglar intar en stor uppsättning ekologiska positioner.[129] Vissa fåglar är generalister, medan andra är högt specialiserade i sitt habitat eller krav på föda. Även inom en enskild miljö, såsom en skog, varierar de ekologiska nischerna som intas av olika fågelarter. Vissa arter födosöker i skogens tak, andra under taket och ytterligare andra på skogens golv. Skogsfåglar kan vara insektsätare, fruktätare och nektarätare. Vattenlevande fåglar livnär sig vanligen av fisk, växter och kleptoparasitism. Rovfåglar specialiserar sig på att jaga däggdjur eller andra fåglar, medan gamar är specialiserade asätare.
Vissa nektarätande fåglar är viktiga som pollinerare, och många fruktätare spelar en nyckelroll i att sprida frön.[161] Växter och pollinerande fåglar utvecklas ofta tillsammans,[162] och i vissa fall är en blommas primära pollinerare den enda art som förmår nå dess nektar.[163]
Fåglar är ofta viktiga för öars ekologi. Fåglar har många gånger nått öar som däggdjur inte har nått. På dessa öar kan fåglarna uppfylla ekologiska roller som vanligen spelas av större djur. Exempelvis var moafåglarna viktiga växtätare på Nya Zeeland, liksom Hemiphaga novaeseelandiae och blå vårtkråka är idag.[161] Idag behåller växterna på Nya Zeeland de försvarsanpassningar som utvecklats för att skydda dem från de utdöda moafåglarna.[164] Häckande havsfåglar kan också påverka öars och omgivande havs ekologi, främst genom koncentration av stora mängder guano, som kan berika den lokala jorden[165] och de omgivande haven.[166]
Livslängd och faror

Havsfåglar lever generellt längre än landlevande fåglar. Hos småfåglar som exempelvis sångare, trastar och mesar dör 50 till 70 procent av beståndet varje år, vilket innebär att en blåmes som är fem år gammal hör till ovanligheten.
Fåglar möter ständigt faror som exempelvis rovdjur, födobrist, kyla, värme och sjukdomar. Under fåglarnas årliga flyttningar utgör stora hav och dålig väderlek som regn och motvind en livshotande fara och man beräknar att många hundratals miljoner fåglar drunknar årligen. Hur stort antal fåglar som totalt dör under sin flyttning är det ingen som vet. Dessa faktorer utgör alla förutsättningen för det Darwin beskrev i sin teori om evolution.
Utöver detta "naturliga" bortfall har människans påverkan på naturen skapat nya hot med habitatförändringar, skövling, jakt, miljögifter, fåglar som dödas i trafiken och fågelpopulationer som trängs undan eller dödas av djur som introduceras av människan. Statistik visar till exempel att Sveriges cirka 1 miljoner katter varje år tar cirka 6 miljoner fåglar [167] och är därmed de djur, utöver fåglar själva, som dödar flest fåglar i Sverige. Under modern tid känner man till mellan 90 till 120 arter (beroende på hur man ser på arter och underarter) som har utrotats.
För ålder- och dräktbeteckningar se ruggning.
Fåglar och människor
Eftersom fåglar är mycket synliga och vanliga djur har människor haft ett förhållande till dem i alla tider.[168] Ibland är dessa relationer mutualistiska, som den kooperativa honungsinsamlingen bland honungsgökar och afrikanska folk som borana.[169] De kan också vara kommensalistiska, som när arter som gråsparven[170] har gynnats av mänsklig verksamhet. Flera fågelarter har blivit ekonomiskt betydande skadedjur i jordbruket,[171] och vissa utgör en fara för flygtrafiken.[172] Mänsklig verksamhet kan också vara skadlig och har gjort många fågelarter utrotningshotade.
Fåglar kan sprida sjukdomar som papegojsjuka, salmonella, kampylobakteriosis, mykobakterios, fågelinfluensa, giardiasis och kryptosporidios över långa avstånd. Några av dessa är zoonoser som också kan överföras till människor.[173]
Ekonomisk betydelse
Många arter av fåglar hålls i fångenskap av människor, som nyttodjur för kött, ägg och fjädrar, samt som sällskapsdjur för deras skönhet, sällskaplighet, sång eller förmåga att härma tal och andra ljud.
När man beskriver fåglar brukar man dela upp dem i å ena sidan de vilda fåglarna och å andra sidan de domesticerade. I jakt- och avelsammanhang benämner man ofta fåglarna i singularis trots att det kan röra sig om ett större släkte eller om olika raser. Några vanliga exempel på termer för fågel som jaktbyte, föremål för fjäderfäavel och mat är anka, broiler, höna, kramsfågel, kyckling, tamgås och viltfågel.
Domesticerade fåglar som föds upp för deras kött och ägg, så kallat fjäderfä, är den största källan till animaliskt protein som äts av människor. År 2003 producerades 76 miljoner ton fjäderfä och 61 miljoner ton ägg i världen.[174] Höns står för en stor del av människors konsumtion av fjäderfä, men kalkoner, ankor och gäss är också relativt vanliga. Många fågelarter jagas också för deras kött. Fågeljakt är främst en fritidssysselsättning förutom i extremt outvecklade områden. De viktigaste fåglarna som jagas i Nordamerika och Sydamerika är vattenfåglar. Bland de andra fåglar som jagas i stor utsträckning finns fasaner, kalkoner, vaktlar, duvor, rapphöns, skogshöns, beckasiner och morkullor.[175] "Muttonbirding" är också populärt i Australien och Nya Zeeland.[176] Även om viss fågeljakt kan vara ekologiskt hållbar, har jakt också gjort att dussintals fågelarter utrotats eller hotas av utrotning.[177]
Andra ekonomiskt värdefulla produkter från fåglar är bland annat fjädrar (särskilt dun från gäss och änder), som används som isolering i kläder och sängkläder, och spillning från havsfåglar (guano), som är en värdefull källa till fosfor och kväve. Stillahavskrigen utkämpades delvis för att få kontroll över guanotillgångar.[178]
Fåglar har domesticerats av människor både som sällskapsdjur och för praktiska syften. Färgstarka fåglar, som papegojor och majnor, avlas i fångenskap eller hålls som sällskapsdjur, vilket har lett till olaglig handel med vissa hotade arter.[179] Falkar och skarvar har länge använts för jakt respektive fiske. Brevduvor, som använts åtminstone sedan år 1 e.Kr., var viktiga så nyligen som under andra världskriget. Idag är sådana verksamheter vanligare som hobby, underhållning och turism,[180] eller sporter som duvsport.
Det finns miljontals fågelentusiaster, så kallade fågelskådare, i världen.[181] Många husägare sätter upp fågelbord nära sina hem för att dra till sig olika arter. Utfodring av fåglar har vuxit till en mångmiljonindustri. Exempelvis ger uppskattningsvis 75% av hushållen i Storbritannien någon gång mat till fåglar på vintern.[182]
Ornitologi
Studiet av fåglar heter ornitologi. Ända sedan Aristoteles har människan studerat och skrivit ned information angående fåglar och deras beteende. Till en början var mycket av detta informationssamlande kopplat till jakt, men upplysningstiden, vetenskapsmän som Linné och senare den naturromantiska vågen på 1800-talet kom att popularisera ornitologin till att bli det vi idag allmänt kallar fågelskådning. I slutet av 1800-talet började enstaka personer experimentera med att individmärka fåglar för olika studier. Ganska snart ledde dessa experiment till den form av ringmärkning som har varit en källa till stor kunskap om fåglars förflyttningar och dylikt. Rent vetenskapligt är det framförallt det senaste femtio åren som forskningen av fåglar har inneburit att många hemligheter och egenheter med fåglars liv och leverne har avslöjats. Ornitologin har spelat ett viktigt roll inom vetenskapsgrenar som systematik, genetik, zoogeografi, zooekologi och beteendevetenskap.
Fåglar fungerar mycket bra som indikatorer på det allmänna miljötillståndet. Detta beror på att de befinner sig högt i näringskedjan och därmed snabbt svarar på förändringar. De täcker upp ett brett spektrum av olika ekologiska nischer och kunskapen om olika fågelarters ekologi är dessutom generellt sett högre än hos andra djurgrupper eller växter. Dessutom är fåglar relativt enkla att identifiera till art och det finns många kvalificerade ornitologer som är möjliga att anlita för fältarbete.
.jpg/140px-Vogel_Drei_(Meister_der_Spielkarten).jpg)
Religion, folklore och kultur
Fåglar spelar framträdande och skiftande roller i folklore, religion och populärkultur. Inom religionen kan fåglar fungera som antingen budbärare eller präster och ledare för en gudom, som i Makemakereligionen där Tangata manu på Påskön fungerade som hövdingar,[183] eller som tjänare, som i fallet Hugin och Munin, två korpar som viskade nyheter i öronen på den nordiske guden Oden.[184] De kan också fungera som religiösa symboler, som när Jona (hebreiska: יוֹנָה, duva) förkroppsligade skräcken, passiviteten, sörjandet och skönheten som traditionellt förknippas med duvor.[185] Fåglar har själva upphöjts till gudar, som påfågeln, som uppfattades som Moder Jord av draviderna i Indien.[186] Vissa fåglar har också uppfattats som vidunder, däribland den mytologiska Fågel Rock och maoriernas legendariska Pouākai, en jättefågel som kunde fånga människor.[187]
Fåglar har förekommit i kultur och konst sedan förhistorisk tid, då de framställdes på tidiga grottmålningar.[188] Fåglar användes senare i religiös eller symbolisk konst och konsthantverk, såsom den mogul- och perserkejsarnas magnifika Påfågelstron.[189] när det vetenskapliga intresset för fåglar vaknade beställdes många målningar av fåglar till böcker. En av de mest berömda av dessa fågelmålare var John James Audubon, vars målningar av nordamerikanska fåglar blev en stor kommersiell framgång i Europa.[190] Fåglar är också viktiga i poesi. Exempelvis införlivade Homeros näktergalar i sin Odyssén och Catullus använde en sparv som erotisk symbol i en dikt.[191] Relationen mellan en albatross och en sjöman är det centrala temat i Samuel Taylor Coleridges The Rime of the Ancient Mariner.[192]
Uppfattningar om olika fågelarter varierar ofta mellan olika kulturer. Ugglor förknippas med otur, häxeri och död i delar av Afrika,[193] men uppfattas som visa i stora delar av Europa.[194] Härfåglar sågs som heliga i Antikens Egypten, men ansågs som tjuvar i stora delar av Europa och som förebud om krig i Skandinavien.[195]
Människans påverkan på fågelfaunan

Fastän mänsklig aktivitet har tillåtit några arter att expandera, såsom ladusvala och stare, har människan orsakat populationsminskning eller utrotning bland många arter. Över hundra fågelarter har dött ut i historisk tid.[196] De mest dramatiska förändringarna i fågelfaunan, orsakade av människor, skedde dock långt tidigare, under koloniseringen av öar i Melanesien, Polynesien och Mikronesien då uppskattningsvis 750-1800 arter dog ut.[197] Många fågelpopulationer minskar över hela världen, och 1 221 arter listades som hotade av Birdlife International och IUCN år 2007.[198] Det hot som ofta anses som det mest allvarliga är fåglarnas habitatförluster på grund av männsikan vilket också leder till att fåglarnas födotillgång minskar.[199] Andra hot är jakt, att de blir bifångst vid fiske med långrev,[200] miljöförstöring (däribland oljeläckage och användning av bekämpningsmedel),[201] konkurrens och predation från introducerade arter,[202] och klimatförändring. Stater och naturskyddsgrupper arbetar för att skydda fåglar, antingen genom att anta lagar som bevarar och restaurera fågelhabitat eller genom att upprätta populationer i fångenskap för återinföranden. Sådana projekt har lett till vissa framgångar. En studie uppskattade att bevarande åtgärder hade räddat 16 fågelarter som annars skulle ha dött ut mellan 1994 och 2004, däribland kalifornisk kondor.[203]
Se även
- Alla artiklar på svenska wikipedia som har prefixet "fågel"
- Fågelrekord
- Sveriges fågelfauna
- Alfabetisk lista över fåglar i Sverige
- Lista över auktorer inom fågeltaxonomin
- Sveriges ornitologiska förening
Referenser
- Denna artikel är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Bird, 2008-06-30.
Noter
- ↑ Alexander Hellquist (2007) Det hänger på fjädrarna, Roadrunner, nr.3, 2007, sid:41
- ↑ del Hoyo, Josep; Andy Elliott & Jordi Sargatal (1992). Handbook of Birds of the World, Volume 1: Ostrich to Ducks. Barcelona: Lynx Edicions. ISBN 84-87334-10-5.
- ↑ (latin) Linnaeus, Carolus (1758). Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. Holmiae. (Laurentii Salvii), 824.
- ↑ 4,0 4,1 Livezey, Bradley C.; Richard L. Zusi (januari 2007). "Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion". Zoological Journal of the Linnean Society 149 (1): 1–95. DOI:10.1111/j.1096-3642.2006.00293.x.
- ↑ Padian, Kevin (1997). "Bird Origins", in Philip J. Currie & Kevin Padian (red.): Encyclopedia of Dinosaurs. San Diego: Academic Press, 41–96. ISBN 0-12-226810-5.
- ↑ Gauthier, Jacques (1986). "Saurischian Monophyly and the origin of birds", in Kevin Padian: The Origin of Birds and the Evolution of Flight, 1–55. ISBN 0-940228-14-9.
- ↑ ”Bird biogeography”. http://people.eku.edu/ritchisong/birdbiogeography1.htm. Läst 2008-04-10.
- ↑ Clements, James F. (2007). The Clements Checklist of Birds of the World, 6th edition, Ithaca: Cornell University Press. ISBN 978-0-8014-4501-9.
- ↑ Gill, Frank (2006). Birds of the World: Recommended English Names. Princeton: Princeton University Press. ISBN 978-0-691-12827-6.
- ↑ Paul, Gregory S. (2002). "Looking for the True Bird Ancestor", Dinosaurs of the Air: The Evolution and Loss of Flight in Dinosaurs and Birds. Baltimore: John Hopkins University Press, 171–224. ISBN 0-8018-6763-0.
- ↑ Norell, Mark; Mick Ellison (2005). Unearthing the Dragon: The Great Feathered Dinosaur Discovery. New York: Pi Press. ISBN 0-13-186266-9.
- ↑ Xu, X., Zhou., Wang, X., Kuang, X., Zhang, F. & Du,X. 2003. Four-winged dinosaurs from China. - Nature 421:335-340.
- ↑ Turner, Alan H.; Pol, Diego; Clarke, Julia A.; Erickson, Gregory M. och Norell, Mark (2007). "A basal dromaeosaurid and size evolution preceding avian flight" (pdf). Science 317: 1378–1381. DOI:10.1126/science.1144066. PMID 17823350.
- ↑ Xing, X., Zhou, Z., Wang, X., Kuang, X., Zhang, F. och Du, X. (2003). "Four-winged dinosaurs from China". Nature 421 (6921): 335–340. DOI:10.1038/nature01342.
- ↑ Thulborn, R.A. (1984). "The avian relationships of Archaeopteryx, and the origin of birds". Zoological Journal of the Linnean Society 82: 119–158. DOI:10.1111/j.1096-3642.1984.tb00539.x.
- ↑ Kurzanov, S.M. (1987). "Avimimidae and the problem of the origin of birds". Transactions of the joint Soviet - Mongolian Paleontological Expedition 31: 31–94.
- ↑ Heilmann, Gerhard. "The origin of birds" (1927) "Dover Publications", New York.
- ↑ Rasskin-Gutman, Diego; Angela D. Buscalioni (mars 2001). "Theoretical morphology of the Archosaur (Reptilia: Diapsida) pelvic girdle". Paleobiology 27 (1): 59–78. DOI:10.1666/0094-8373(2001).
- ↑ Paul, Gregory S. (2002). Dinosaurs of the air: the evolution and loss of flight in dinosaurs and birds. Baltimore: Johns Hopkins University Press, 224-258. ISBN 0-8018-6763-0.
- ↑ Feduccia, Alan; Theagarten Lingham-Soliar, J. Richard Hinchliffe (november 2005). "Do feathered dinosaurs exist? Testing the hypothesis on neontological and paleontological evidence". Journal of Morphology 266 (2): 125–66. DOI:10.1002/jmor.10382. PMID 16217748.
- ↑ Prum, Richard O. (april 2003). "Are Current Critiques Of The Theropod Origin Of Birds Science? Rebuttal To Feduccia 2002". The Auk 120 (2): 550–61. DOI:[0550:ACCOTT2.0.CO;2 10.1642/0004-8038(2003)120[0550:ACCOTT]2.0.CO;2].
- ↑ Zhou, Zhonghe (oktober 2004). "The origin and early evolution of birds: discoveries, disputes, and perspectives from fossil evidence". Die Naturwissenschaften 91 (10): 455–71. DOI:10.1007/s00114-004-0570-4.
- ↑ 23,0 23,1 23,2 23,3 23,4 Chiappe, Luis M. (2007). Glorified Dinosaurs: The Origin and Early Evolution of Birds. Sydney: University of New South Wales Press. ISBN 978-0-86840-413-4.
- ↑ Clarke, Julia A. (september 2004). "Morphology, Phylogenetic Taxonomy, and Systematics of Ichthyornis and Apatornis (Avialae: Ornithurae)". Bulletin of the American Museum of Natural History 286: 1–179.
 PDF
PDF - ↑ Clarke, Julia A.; Claudia P. Tambussi, Jorge I. Noriega, Gregory M. Erickson och Richard A. Ketcham (January 2005). "Definitive fossil evidence for the extant avian radiation in the Cretaceous". Nature 433: 305–308. DOI:10.1038/nature03150. PMID 15662422. Supporting information
- ↑ 26,0 26,1 Ericson, Per G.P.; Cajsa L. Anderson, Tom Britton et al. (december 2006). "Diversification of Neoaves: Integration of molecular sequence data and fossils" (Mall:Dead link – Scholar search). Biology Letters 2 (4): 543–547. DOI:10.1098/rsbl.2006.0523. PMID 17148284.
- ↑ Brown, Joseph W.; Robert B. Payne, David P. Mindell (juni 2007). "Nuclear DNA does not reconcile 'rocks' and 'clocks' in Neoaves: a comment on Ericson et al.". Biology Letters 3 (3): 257–259. DOI:10.1098/rsbl.2006.0611. PMID 17389215.
- ↑ Sibley, Charles; Jon Edward Ahlquist (1990). Phylogeny and classification of birds. New Haven: Yale University Press. ISBN 0-300-04085-7.
- ↑ Mayr, Ernst; Short, Lester L. (1970). Species Taxa of North American Birds/A Contribution to Comparative Systematics. Cambridge: Nuttal Ornithological Club. OCLC 517185.
- ↑ Ericson et al (2006), Diversification of Neoaves: integration of molecular sequence data and fossils, Biology Letters, vol.2, sid:543-547, 10.1098/rsbl.2006.0523, nätpublicerad (pdf)9 aug 2006
- ↑ Newton, Ian (2003). The Speciation and Biogeography of Birds. Amsterdam: Academic Press, s. 463. ISBN 0-12-517375-X.
- ↑ Brooke, Michael (2004). Albatrosses And Petrels Across The World. Oxford: Oxford University Press. ISBN 0-19-850125-0.
- ↑ 33,0 33,1 Schreiber, Elizabeth Anne; Joanna Burger (2001). Biology of Marine Birds. Boca Raton: CRC Press. ISBN 0-8493-9882-7.
- ↑ Sato, Katsufumi; Y. Naito, A. Kato et al. (maj 2002). "Buoyancy and maximal diving depth in penguins: do they control inhaling air volume?". Journal of Experimental Biology 205 (9): 1189–1197. PMID 11948196.
- ↑ Hill, David; Peter Robertson (1988). The pheasant: Ecology, Management, and Conservation. Oxford: BSP Professional. ISBN 0-632-02011-3.
- ↑ Spreyer, Mark F.; Enrique H. Bucher (1998). ”Monk Parakeet (Myiopsitta monachus)”. The Birds of North America. Cornell Lab of Ornithology. doi:. http://bna.birds.cornell.edu/bna/species/322.
- ↑ Arendt, Wayne J. (1988). "Range Expansion of the Cattle Egret, (Bubulcus ibis) in the Greater Caribbean Basin". Colonial Waterbirds 11 (2): 252–62. DOI:10.2307/1521007.
- ↑ Juniper, Tony; Mike Parr (1998). Parrots: A Guide to the Parrots of the World. London: Christopher Helm. ISBN 0-7136-6933-0.
- ↑ Ian Newton, The Speciation and Biogeography of birds, Academic Press, London, 2003.
- ↑ Weir, Jason T.; Dolph Schluter (mars 2007). "The Latitudinal Gradient in Recent Speciation and Extinction Rates of Birds and Mammals". Science 315 (5818): 1574–76. DOI:10.1126/science.1135590. PMID 17363673.
- ↑ Staffan Ulfstrand, Vad nytta gör en halv vinge?, Vår fågelvärld, nr 6, 2006
- ↑ Warham, John (1977). "The Incidence, Function and ecological significance of petrel stomach oils". Proceedings of the New Zealand Ecological Society 24: 84–93. DOI:10.2307/1365556.
- ↑ Dumbacher, J.P.; B.M. Beehler, T.F. Spande et al. (oktober 1992). "omobatrachotoxin in the genus Pitohui: chemical defense in birds?". Science 258 (5083): 799–801. DOI:10.1126/science.1439786. PMID 1439786.
- ↑ 44,00 44,01 44,02 44,03 44,04 44,05 44,06 44,07 44,08 44,09 44,10 44,11 44,12 44,13 44,14 44,15 44,16 44,17 44,18 44,19 44,20 44,21 44,22 44,23 44,24 44,25 44,26 Gill, Frank (1995). Ornithology. New York: WH Freeman and Co. ISBN 0-7167-2415-4.
- ↑ Göth, Anne (2007). "Incubation temperatures and sex ratios in Australian brush-turkey (Alectura lathami) mounds". Austral Ecology 32 (4): 278–85. DOI:10.1111/j.1442-9993.2007.01709.x.
- ↑ Ehrlich, Paul R.; David S. Dobkin och Darryl Wheye (1988). ”Adaptations for Flight”. Birds of Stanford. Stanford University. http://www.stanford.edu/group/stanfordbirds/text/essays/Adaptations.html. Läst 2007-12-13. Baserad på The Birder's Handbook (Paul Ehrlich, David Dobkin och Darryl Wheye. 1988. Simon and Schuster, New York.)
- ↑ ”The Avian Skeleton”. paulnoll.com. http://www.paulnoll.com/Oregon/Birds/Avian-Skeleton.html. Läst 2007-12-13.
- ↑ ”Halskotor - Naturhistoriska riksmuseet”. http://www.nrm.se/sv/meny/faktaomnaturen/djur/faglar/skelettfranfaglar/faglarsskelett/halskotor.376.html. Läst 18 maj 2009.
- ↑ ”Skeleton of a typical bird”. Fernbank Science Center's Ornithology Web. http://fsc.fernbank.edu/Birding/skeleton.htm. Läst 2007-12-13.
- ↑ Ehrlich, Paul R.; David S. Dobkin och Darryl Wheye (1988). ”Drinking”. Birds of Stanford. Stanford University. http://www.stanford.edu/group/stanfordbirds/text/essays/Drinking.html. Läst 2007-12-13.
- ↑ Tsahar, Ella; Carlos Martínez del Rio, Ido Izhaki och Zeev Arad (2005). "Can birds be ammonotelic? Nitrogen balance and excretion in two frugivores". Journal of Experimental Biology 208 (6): 1025–34. DOI:10.1242/jeb.01495. PMID 15767304.
- ↑ Preest, Marion R.; Carol A. Beuchat (april 1997). "Ammonia excretion by hummingbirds". Nature 386: 561–62. DOI:10.1038/386561a0.
- ↑ Mora, J.; J. Martuscelli, Juana Ortiz-Pineda och G. Soberón (1965). "The Regulation of Urea-Biosynthesis Enzymes in Vertebrates". Biochemical Journal 96: 28–35. PMID 14343146.
- ↑ Packard, Gary C. (1966). "[http://links.jstor.org/sici?sici=0003-0147(196611/12)100:916%3C667:TIOATA%3E2.0.CO;2-T The Influence of Ambient Temperature and Aridity on Modes of Reproduction and Excretion of Amniote Vertebrates]". The American Naturalist 100 (916): 667–82. DOI:10.1086/282459.
- ↑ Balgooyen, Thomas G. (1971). "Pellet Regurgitation by Captive Sparrow Hawks (Falco sparverius)". Condor 73 (3): 382–85. DOI:10.2307/1365774.
- ↑ Gionfriddo, James P.; Louis B. Best (februari 1995). "Grit Use by House Sparrows: Effects of Diet and Grit Size". Condor 97 (1): 57–67. DOI:10.2307/1368983.
- ↑ 57,0 57,1 57,2 Attenborough, David (1998). The Life of Birds. Princeton: Princeton University Press. ISBN 0-691-01633-X.
- ↑ 58,0 58,1 Battley, Phil F.; Theunis Piersma, Maurine W. Dietz et al. (januari 2000). "Empirical evidence for differential organ reductions during trans-oceanic bird flight". Proceedings of the Royal Society B 267 (1439): 191–5. DOI:10.1098/rspb.2000.0986. PMID 10687826. (Erratum i Proceedings of the Royal Society B 267(1461):2567.)
- ↑ Maina, John N. (November 2006). "Development, structure, and function of a novel respiratory organ, the lung-air sac system of birds: to go where no other vertebrate has gone". Biological Reviews 81 (4): 545–79. DOI:10.1111/j.1469-185X.2006.tb00218.x. PMID 17038201.
- ↑ 60,0 60,1 Suthers, Roderick A.; Sue Anne Zollinger (2004). "Producing song: the vocal apparatus", in H. Philip Zeigler & Peter Marler (red.): Behavioral Neurobiology of Birdsong, Annals of the New York Academy of Sciences 1016. New York: New York Academy of Sciences, 109-129. DOI:10.1196/annals.1298.041. ISBN 1-57331-473-0. PMID 15313772
- ↑ Scott, Robert B. (mars 1966). "Comparative hematology: The phylogeny of the erythrocyte". Annals of Hematology 12 (6): 340–51. DOI:10.1007/BF01632827. PMID 5325853.
- ↑ Roots, Clive (2006). Flightless Birds. Westport: Greenwood Press. ISBN 978-0-313-33545-7.
- ↑ McNab, Brian K. (oktober 1994). "Energy Conservation and the Evolution of Flightlessness in Birds". The American Naturalist 144 (4): 628–42. DOI:10.1086/285697.
- ↑ Kovacs, Christopher E.; Ron A. Meyers (maj 2000). "Anatomy and histochemistry of flight muscles in a wing-propelled diving bird, the Atlantic Puffin, Fratercula arctica". Journal of Morphology 244 (2): 109–25. DOI:
<109::AID-JMOR2>3.0.CO;2-0 10.1002/(SICI)1097-4687(200005)244:2
<109::AID-JMOR2>3.0.CO;2-0. - ↑ Sales, James (2005). "The endangered kiwi: a review". Folia Zoologica 54 (1–2): 1–20.
- ↑ Ehrlich, Paul R.; David S. Dobkin och Darryl Wheye (1988). ”The Avian Sense of Smell”. Birds of Stanford. Stanford University. http://www.stanford.edu/group/stanfordbirds/text/essays/Avian_Sense.html. Läst 2007-12-13.
- ↑ Lequette, Benoit; Christophe Verheyden, Pierre Jouventin (augusti 1989). "Olfaction in Subantarctic seabirds: Its phylogenetic and ecological significance". The Condor 91 (3): 732–35. DOI:10.2307/1368131.
- ↑ Saito, Nozomu (1978). "Physiology and anatomy of avian ear". The Journal of the Acoustical Society of America 64 (S1): S3. DOI:10.1121/1.2004193.
- ↑ Wilkie, Susan E.; Peter M. A. M. VISSERS, Debipriya DAS et al. (1998). "The molecular basis for UV vision in birds: spectral characteristics, cDNA sequence and retinal localization of the UV-sensitive visual pigment of the budgerigar (Melopsittacus undulatus)". Biochemical Journal 330: 541–47. PMID 9461554.
- ↑ [http://www.pnas.org/cgi/content/abstract/102/18/6391 maxtoshow=&HITS=10&hits=10&RESULTFORMAT=&fulltext=%22blue+tit%22&searchid=1&FIRSTINDEX=0&resourcetype=HWCIT Proceedings of the National Academy of Sciences]
- ↑ Andersson, S. (1998). "Ultraviolet sexual dimorphism and assortative mating in blue tits". Proceeding of the Royal Society B 265 (1395): 445–50. DOI:10.1098/rspb.1998.0315.
- ↑ Viitala, Jussi; Erkki Korplmäki, Pälvl Palokangas & Minna Koivula (1995). "Attraction of kestrels to vole scent marks visible in ultraviolet light". Nature 373 (6513): 425–27. DOI:10.1038/373425a0.
- ↑ Williams, David L.; Edmund Flach (mars 2003). "Symblepharon with aberrant protrusion of the nictitating membrane in the snowy owl (Nyctea scandiaca)". Veterinary Ophthalmology 6 (1): 11–13. DOI:10.1046/j.1463-5224.2003.00250.x. PMID 12641836.
- ↑ White, Craig R.; Norman Day, Patrick J. Butler, Graham R. Martin (juli 2007). "Vision and Foraging in Cormorants: More like Herons than Hawks?". PLoS ONE 2 (7): e639. DOI:10.1371/journal.pone.0000639. PMID 17653266.
- ↑ Martin, Graham R.; Gadi Katzir (1999). "Visual fields in short-toed eagles, Circaetus gallicus (Accipitridae), and the function of binocularity in birds". Brain, Behaviour and Evolution 53 (2): 55–66. DOI:10.1159/000006582. PMID 9933782.
- ↑ [http://www.biol.lu.se/zoofysiol/Svar/Sinne.html#Vrak Institutionen för cell- och organismbiologi vid Lunds Universitet]
- ↑ Rattenborg NC (2006): Evolution of slow-wave sleep and palliopallial connectivity in mammals and birds: a hypothesis; Brain Res Bull 69(1):20-29
- ↑ Kavanau JL (2002): REM and NREM sleep as natural accompaniments of the evolution of warm-bloodedness; Neuroscience and Biobehavioral Reviews 26(8):889-906
- ↑ Rattenborg NC, Amlaner CJ, Lima SL (2000): Behavioral, neurophysiological and evolutionary perspectives on unihemispheric sleep; Neurosci Biobehav Rev 24(8):817-42
- ↑ Belthoff, James R.; Alfred M. Dufty, Jr., Sidney A. Gauthreaux, Jr. (augusti 1994). "Plumage Variation, Plasma Steroids and Social Dominance in Male House Finches". The Condor 96 (3): 614–25. DOI:10.2307/1369464.
- ↑ Guthrie, R. Dale. ”How We Use and Show Our Social Organs”. Body Hot Spots: The Anatomy of Human Social Organs and Behavior. http://employees.csbsju.edu/lmealey/hotspots/chapter03.htm. Läst 2007-10-19.
- ↑ de Beer SJ, Lockwood GM, Raijmakers JHFS, Raijmakers JMH, Scott WA, Oschadleus HD, Underhill LG (2001). SAFRING Bird Ringing Manual. SAFRING.
- ↑ Gargallo, Gabriel (1994). "Flight Feather Moult in the Red-Necked Nightjar Caprimulgus ruficollis". Journal of Avian Biology 25 (2): 119–24. DOI:10.2307/3677029.
- ↑ Mayr, Ernst; Margaret Mayr (1954). "The tail molt of small owls". The Auk 71 (2): 172–78. DOI:10.1086/515854.
- ↑ Payne, Robert B.. ”Birds of the World, Biology 532”. http://www.ummz.umich.edu/birds/resources/families_otw.html. Läst 2007-10-20.
- ↑ Turner, J. Scott (1997). "On the thermal capacity of a bird's egg warmed by a brood patch". Physiological Zoology 70 (4): 470–80. DOI:10.1086/515854. PMID 9237308.
- ↑ Walther, Bruno A.; Dale H. Clayton (2005). "Elaborate ornaments are costly to maintain: evidence for high maintenance handicaps". Behavioural Ecology 16 (1): 89–95. DOI:10.1093/beheco/arh135.
- ↑ Shawkey, Matthew D.; Shawkey, Shreekumar R. Pillai, Geoffrey E. Hill (2003). "Chemical warfare? Effects of uropygial oil on feather-degrading bacteria". Journal of Avian Biology 34 (4): 345–49. DOI:10.1111/j.0908-8857.2003.03193.x.
- ↑ Ehrlich, Paul R.; David S. Dobkin, Darryl Wheye (1986). "The Adaptive Significance of Anting" (Mall:Dead link – Scholar search). The Auk 103 (4): 835.
- ↑ Lucas, Alfred M. (1972). Avian Anatomy - integument. East Lansing, Michigan, USA: USDA Avian Anatomy Project, Michigan State University, 67, 344, 394-601.
- ↑ Robert, Michel; Raymond McNeil, Alain Leduc (January 1989). "Conditions and significance of night feeding in shorebirds and other water birds in a tropical lagoon". The Auk 106 (1): 94–101.
- ↑ Paton, D. C.; B. G. Collins (1989). "Bills and tongues of nectar-feeding birds: A review of morphology, function, and performance, with intercontinental comparisons". Australian Journal of Ecology 14 (4): 473–506. DOI:10.2307/1942194.
- ↑ Baker, Myron Charles; Ann Eileen Miller Baker (1973). "Niche Relationships Among Six Species of Shorebirds on Their Wintering and Breeding Ranges". Ecological Monographs 43 (2): 193–212. DOI:10.2307/1942194.
- ↑ Cherel, Yves; Pierrick Bocher, Claude De Broyer et als. (2002). "Food and feeding ecology of the sympatric thin-billed Pachyptila belcheri and Antarctic P. desolata prions at Iles Kerguelen, Southern Indian Ocean". Marine Ecology Progress Series 228: 263–81. DOI:10.3354/meps228263.
- ↑ Jenkin, Penelope M. (1957). "The Filter-Feeding and Food of Flamingoes (Phoenicopteri).". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 240 (674): 401–93. DOI:10.1098/rstb.1957.0004.
- ↑ Miyazaki, Masamine (July 1996). "Vegetation cover, kleptoparasitism by diurnal gulls and timing of arrival of nocturnal Rhinoceros Auklets". The Auk 113 (3): 698–702. DOI:10.2307/3677021.
- ↑ Bélisle, Marc; Jean-François Giroux (August 1995). "Predation and kleptoparasitism by migrating Parasitic Jaegers". The Condor 97 (3): 771–781. DOI:10.2307/1369185.
- ↑ Vickery, J. A.; M. De L. Brooke (May 1994). "The Kleptoparasitic Interactions between Great Frigatebirds and Masked Boobies on Henderson Island, South Pacific". The Condor 96 (2): 331–40. DOI:10.2307/1369318.
- ↑ Hiraldo, F.C.; J.C. Blanco and J. Bustamante (1991). "Unspecialized exploitation of small carcasses by birds". Bird Studies 38 (3): 200–07. DOI:10.1007/s10646-008-0193-1..
- ↑ Klaassen, Marc (1996). "Metabolic constraints on long-distance migration in birds". Journal of Experimental Biology 199 (1): 57–64. PMID 9317335.
- ↑ ”Long-distance Godwit sets new record”. BirdLife International. 05-04-2007. http://www.birdlife.org/news/news/2007/04/bar-tailed_godwit_journey.html. Läst 2007-12-13.
- ↑ Shaffer, Scott A.; Yann Tremblay, Henri Weimerskirch et als (2006). "Migratory shearwaters integrate oceanic resources across the Pacific Ocean in an endless summer". Proceedings of the National Academy of Sciences 103 (34): 12799–802. DOI:10.1073/pnas.0603715103. PMID 16908846.
- ↑ Croxall, John P.; Janet R. D. Silk, Richard A. Phillips et als. (2005). "Global Circumnavigations: Tracking year-round ranges of nonbreeding Albatrosses". Science 307 (5707): 249–50. DOI:10.1126/science.1106042. PMID 15653503.
- ↑ Wilson, W. Herbert, Jr. (1999). "Bird feeding and irruptions of northern finches:are migrations short stopped?". North America Bird Bander 24 (4): 113–21.
- ↑ Nilsson, Anna L. K.; Thomas Alerstam, and Jan-Åke Nilsson (2006). "Do partial and regular migrants differ in their responses to weather?". The Auk 123 (2): 537–47. DOI:[537:DPARMD2.0.CO;2 10.1642/0004-8038(2006)123[537:DPARMD]2.0.CO;2].
- ↑ Chan, Ken (2001). "Partial migration in Australian landbirds: a review". Emu 101 (4): 281–92. DOI:10.1071/MU00034.
- ↑ Rabenold, Kerry N.; Patricia Parker Rabenold (1985). "Variation in Altitudinal Migration, Winter Segregation, and Site Tenacity in two subspecies of Dark-eyed Juncos in the southern Appalachians". The Auk 102 (4): 805–19.
- ↑ Collar, Nigel J. (1997). "Family Psittacidae (Parrots)", in Josep del Hoyo, Andrew Elliott & Jordi Sargatal (eds.): Handbook of the Birds of the World, Volume 4: Sandgrouse to Cuckoos. Barcelona: Lynx Edicions. ISBN 84-87334-22-9.
- ↑ Matthews, G. V. T. (1953). "Navigation in the Manx Shearwater". Journal of Experimental Biology 30 (2): 370–96.
- ↑ Mouritsen, Henrik; Ole Næsbye Larsen (2001). "Migrating songbirds tested in computer-controlled Emlen funnels use stellar cues for a time-independent compass". Journal of Experimental Biology 204 (8): 3855–65. PMID 11807103.
- ↑ Deutschlander, Mark E.; John B. Phillips and S. Chris Borland (1999). "The case for light-dependent magnetic orientation in animals". Journal of Experimental Biology 202 (8): 891–908. PMID 10085262.
- ↑ Gauthier-Clerc, Michael; Alain Tamisier, Frank Cezilly (May 2000). "Sleep-Vigilance Trade-off in Gadwall during the Winter Period". The Condor 102 (2): 307–13. DOI:[0307:SVTOIG2.0.CO;2 10.1650/0010-5422(2000)102[0307:SVTOIG]2.0.CO;2].
- ↑ Rattenborg, Niels C. (2006). "Do birds sleep in flight?". Die Naturwissenschaften 93 (9): 413–25. DOI:10.1007/s00114-006-0120-3.
- ↑ Milius, S. (1999). "Half-asleep birds choose which half dozes" (Mall:Dead link – Scholar search). Science News Online 155: 86. DOI:10.2307/4011301.
- ↑ Beauchamp, Guy (1999). "The evolution of communal roosting in birds: origin and secondary losses". Behavioural Ecology 10 (6): 675–87. DOI:10.1093/beheco/10.6.675.
- ↑ Buttemer, William A. (1985). "Energy relations of winter roost-site utilization by American goldfinches (Carduelis tristis)". Oecologia 68 (1): 126–32. DOI:10.1007/BF00379484.
- ↑ Buckley, F. G.; P. A. Buckley (1968). "Upside-down Resting by Young Green-Rumped Parrotlets (Forpus passerinus)". The Condor 70 (1): 89. DOI:10.2307/1366517.
- ↑ Carpenter, F. Lynn (1974). "Torpor in an Andean Hummingbird: Its Ecological Significance". Science 183 (4124): 545–47. DOI:10.1126/science.183.4124.545. PMID 17773043.
- ↑ McKechnie, Andrew E.; Robert A. M. Ashdown, Murray B. Christian and R. Mark Brigham (2007). "Torpor in an African caprimulgid, the freckled nightjar Caprimulgus tristigma". Journal of Avian Biology 38 (3): 261–66. DOI:10.1111/j.2007.0908-8857.04116.x.
- ↑ Möller, Anders Pape (1988). "Badge size in the house sparrow Passer domesticus". Behavioral Ecology and Sociobiology 22 (5): 373–78. DOI:10.1007/BF00295107.
- ↑ Thomas, Betsy Trent; Stuart D. Strahl (1990). "Nesting Behavior of Sunbitterns (Eurypyga helias) in Venezuela". The Condor 92 (3): 576–81. DOI:10.2307/1368675.
- ↑ Pickering, S. P. C.; S. D. Berrow (2001). "Courtship behaviour of the Wandering Albatross Diomedea exulans at Bird Island, South Georgia". Marine Ornithology 29 (1): 29–37.
- ↑ Pruett-Jones, S. G.; M. A. Pruett-Jones (May 1990). "Sexual Selection Through Female Choice in Lawes' Parotia, A Lek-Mating Bird of Paradise". Evolution 44 (3): 486–501. DOI:10.2307/2409431.
- ↑ Genevois, F.; V. Bretagnolle (1994). "Male Blue Petrels reveal their body mass when calling". Ethology Ecology and Evolution 6 (3): 377–83.
- ↑ Jouventin, Pierre; Thierry Aubin and Thierry Lengagne (1999). "Finding a parent in a king penguin colony: the acoustic system of individual recognition". Animal Behaviour 57 (6): 1175–83. DOI:10.1006/anbe.1999.1086. PMID 10373249.
- ↑ Templeton, Christopher N.; Greene och Kate Davis (2005). "Allometry of Alarm Calls: Black-Capped Chickadees Encode Information About Predator Size". Science 308 (5730): 1934–37. DOI:10.1126/science.1108841. PMID 15976305.
- ↑ Miskelly, C. M. (juli 1987). "The identity of the hakawai". Notornis 34 (2): 95–116.
- ↑ Murphy, Stephen; Sarah Legge och Robert Heinsohn (2003). "The breeding biology of palm cockatoos (Probosciger aterrimus): a case of a slow life history". Journal of Zoology 261 (4): 327–39. DOI:10.1017/S0952836903004175.
- ↑ 129,0 129,1 Sekercioglu, Cagan Hakki (2006). "Foreword", in Josep del Hoyo, Andrew Elliott & David Christie (eds.): Handbook of the Birds of the World, Volume 11: Old World Flycatchers to Old World Warblers. Barcelona: Lynx Edicions, p. 48. ISBN 84-96553-06-X.
- ↑ Terborgh, John (2005). "Mixed flocks and polyspecific associations: Costs and benefits of mixed groups to birds and monkeys". American Journal of Primatology 21 (2): 87–100. DOI:10.1002/ajp.1350210203.
- ↑ Hutto, Richard L. (January 988). "Foraging Behavior Patterns Suggest a Possible Cost Associated with Participation in Mixed-Species Bird Flocks". Oikos 51 (1): 79–83. DOI:10.2307/3565809.
- ↑ Au, David W. K.; Robert L. Pitman (August 1986). "Seabird interactions with Dolphins and Tuna in the Eastern Tropical Pacific". The Condor 88 (3): 304–17. DOI:10.2307/1368877.
- ↑ Anne, O.; E. Rasa (June 1983). "Dwarf mongoose and hornbill mutualism in the Taru desert, Kenya". Behavioral Ecology and Sociobiology 12 (3): 181–90. DOI:10.1007/BF00290770.
- ↑ Warnock, Nils & Sarah (2001). "Sandpipers, Phalaropes and Allies" in The Sibley Guide to Bird Life and Behaviour (eds Chris Elphick, John B. Dunning, Jr & David Sibley) London: Christopher Helm, ISBN 0-7136-6250-6
- ↑ Freed, Leonard A. (1987). "The Long-Term Pair Bond of Tropical House Wrens: Advantage or Constraint?". The American Naturalist 130 (4): 507–25. DOI:10.1086/284728.
- ↑ Gowaty, Patricia A. (1983). "Male Parental Care and Apparent Monogamy among Eastern Bluebirds(Sialia sialis)". The American Naturalist 121 (2): 149–60. DOI:10.1086/284047.
- ↑ Westneat, David F.; Ian R. K. Stewart (2003). "Extra-pair paternity in birds: Causes, correlates, and conflict". Annual Review of Ecology, Evolution, and Systematics 34: 365–96. DOI:10.1146/annurev.ecolsys.34.011802.132439.
- ↑ Gowaty, Patricia A.; Nancy Buschhaus (1998). "Ultimate causation of aggressive and forced copulation in birds: Female resistance, the CODE hypothesis, and social monogamy". American Zoologist 38 (1): 207–25. DOI:10.1093/icb/38.1.207.
- ↑ Sheldon, B (1994). "Male Phenotype, Fertility, and the Pursuit of Extra-Pair Copulations by Female Birds". Proceedings: Biological Sciences 257 (1348): 25–30. DOI:10.1098/rspb.1994.0089.
- ↑ Wei, G; Z Yin, F Lei (2005). "Copulations and mate guarding of the Chinese Egret". Waterbirds 28 (4): 527–30. DOI:[527:CAMGOT2.0.CO;2 10.1675/1524-4695(2005)28[527:CAMGOT]2.0.CO;2].
- ↑ Short, Lester L. (1993). Birds of the World and their Behavior. New York: Henry Holt and Co. ISBN 0-8050-1952-9.
- ↑ Burton, R (1985). Bird Behavior. Alfred A. Knopf, Inc.. ISBN 0-394-53857-5.
- ↑ Schamel, D; DM Tracy, DB Lank, DF Westneat (2004). "Mate guarding, copulation strategies and paternity in the sex-role reversed, socially polyandrous red-necked phalarope Phalaropus lobatus". Behaviour Ecology and Sociobiology 57 (2): 110–18. DOI:10.1007/s00265-004-0825-2.
- ↑ Kokko H, Harris M, Wanless S (2004). "Competition for breeding sites and site-dependent population regulation in a highly colonial seabird, the common guillemot Uria aalge." Journal of Animal Ecology 73 (2): 367–76. doi:10.1111/j.0021-8790.2004.00813.x
- ↑ Booker L, Booker M (1991). "Why Are Cuckoos Host Specific?" Oikos 57 (3): 301–09. doi:10.2307/3565958
- ↑ 146,0 146,1 Hansell M (2000). Bird Nests and Construction Behaviour. University of Cambridge Press ISBN 0-521-46038-7
- ↑ Lafuma L, Lambrechts M, Raymond M (2001). "Aromatic plants in bird nests as a protection against blood-sucking flying insects?" Behavioural Processes 56 (2) 113–20. doi:10.1016/S0376-6357(01)00191-7
- ↑ Warham, J. (1990) The Petrels - Their Ecology and Breeding Systems London: Academic Press ISBN 0-12-735420-4.
- ↑ Jones DN, Dekker, René WRJ, Roselaar, Cees S (1995). The Megapodes. Bird Families of the World 3. Oxford University Press: Oxford. ISBN 0-19-854651-3
- ↑ Elliot A (1994). "Family Megapodiidae (Megapodes)" i Handbook of the Birds of the World. Volume 2; New World Vultures to Guineafowl (eds del Hoyo J, Elliott A, Sargatal J) Lynx Edicions:Barcelona. ISBN 84-87334-15-6
- ↑ Metz VG, Schreiber EA (2002). "Great Frigatebird (Fregata minor)" I The Birds of North America, No 681, (Poole, A. & Gill, F., red.) The Birds of North America Inc: Philadelphia
- ↑ Ekman J (2006). "Family living amongst birds." Journal of Avian Biology 37 (4): 289–98. doi:10.1111/j.2006.0908-8857.03666.x
- ↑ Cockburn A (1996). "Why do so many Australian birds cooperate? Social evolution in the Corvida", in Floyd R, Sheppard A, de Barro P: Frontiers in Population Ecology. Melbourne: CSIRO, 21–42.
- ↑ Cockburn, Andrew (2006). "Prevalence of different modes of parental care in birds". Proceedings: Biological Sciences 273 (1592): 1375–83. DOI:10.1098/rspb.2005.3458. PMID 16777726.
- ↑ Gaston AJ (1994). Ancient Murrelet (Synthliboramphus antiquus). I The Birds of North America, No. 132 (A. Poole and F. Gill, red.). Philadelphia: The Academy of Natural Sciences; Washington, D.C.: The American Ornithologists' Union.
- ↑ Schaefer HC, Eshiamwata GW, Munyekenye FB, Bohning-Gaese K (2004). "Life-history of two African Sylvia warblers: low annual fecundity and long post-fledging care." Ibis 146 (3): 427–37. doi:10.1111/j.1474-919X.2004.00276.x
- ↑ Alonso JC, Bautista LM, Alonso JA (2004). "Family-based territoriality vs flocking in wintering common cranes Grus grus." Journal of Avian Biology 35 (5): 434–44. doi:10.1111/j.0908-8857.2004.03290.x
- ↑ 158,0 158,1 Davies N (2000). Cuckoos, Cowbirds and other Cheats. T. & A. D. Poyser: London ISBN 0-85661-135-2
- ↑ Sorenson M (1997). "Effects of intra- and interspecific brood parasitism on a precocial host, the canvasback, Aythya valisineria." Behavioral Ecology 8 (2) 153–61. PDF
- ↑ Spottiswoode C, Colebrook-Robjent J (2007). "Egg puncturing by the brood parasitic Greater Honeyguide and potential host counteradaptations." Behavioral Ecology doi:10.1093/beheco/arm025
- ↑ 161,0 161,1 Clout M, Hay J (1989). "The importance of birds as browsers, pollinators and seed dispersers in New Zealand forests." New Zealand Journal of Ecology 12 27–33 PDF
- ↑ Stiles F (1981). "Geographical Aspects of Bird–Flower Coevolution, with Particular Reference to Central America." Annals of the Missouri Botanical Garden 68 (2) 323–51. doi:10.2307/2398801
- ↑ Temeles E, Linhart Y, Masonjones M, Masonjones H (2002). "The Role of Flower Width in Hummingbird Bill Length–Flower Length Relationships." Biotropica 34 (1): 68–80. PDF
- ↑ Bond W, Lee W, Craine J (2004). "Plant structural defences against browsing birds: a legacy of New Zealand's extinct moas." Oikos 104 (3), 500–08. doi:10.1111/j.0030-1299.2004.12720.x
- ↑ Wainright S, Haney J, Kerr C, Golovkin A, Flint M (1998). "Utilization of nitrogen derived from seabird guano by terrestrial and marine plants at St. Paul, Pribilof Islands, Bering Sea, Alaska." Marine Ecology 131 (1) 63–71. PDF
- ↑ Bosman A, Hockey A (1986). "Seabird guano as a determinant of rocky intertidal community structure." Marine Ecology Progress Series 32: 247–57 PDF
- ↑ SOF - omräkning från engelsk studie utförd av The Mammal Society 1998
- ↑ Bonney, Rick; Rohrbaugh, Jr., Ronald (2004), Handbook of Bird Biology (utgåva Second), Princeton, NJ: Princeton University Press, ISBN 0-938-02762-X
- ↑ Dean W, Siegfried R, MacDonald I (1990). "The Fallacy, Fact, and Fate of Guiding Behavior in the Greater Honeyguide." Conservation Biology 4 (1) 99–101. PDF
- ↑ Singer R, Yom-Tov Y (1988). "The Breeding Biology of the House Sparrow Passer domesticus in Israel." Ornis Scandinavica 19 139–44. doi:10.2307/3676463
- ↑ Dolbeer R (1990). "Ornithology and integrated pest management: Red-winged blackbirds Agleaius phoeniceus and corn." Ibis 132 (2): 309–22.
- ↑ Dolbeer R, Belant J, Sillings J (1993). "Shooting Gulls Reduces Strikes with Aircraft at John F. Kennedy International Airport." Wildlife Society Bulletin 21: 442–50.
- ↑ Reed KD, Meece JK, Henkel JS, Shukla SK (2003). "Birds, Migration and Emerging Zoonoses: West Nile Virus, Lyme Disease, Influenza A and Enteropathogens." Clin Med Res. 1 (1):5–12. PMID 15931279
- ↑ Shifting protein sources: Chapter 3: Moving Up the Food Chain Efficiently. Earth Policy Institute. Hämtad 18 december 2007.
- ↑ Simeone A, Navarro X (2002). "Human exploitation of seabirds in coastal southern Chile during the mid-Holocene." Rev. chil. hist. nat 75 (2): 423–31
- ↑ Hamilton S (2000). "How precise and accurate are data obtained using. an infra-red scope on burrow-nesting sooty shearwaters Puffinus griseus?" Marine Ornithology 28 (1): 1–6 PDF
- ↑ Keane A, Brooke MD, Mcgowan PJK (2005). "Correlates of extinction risk and hunting pressure in gamebirds (Galliformes)." Biological Conservation 126 (2): 216–33. doi:10.1016/j.biocon.2005.05.011
- ↑ The Guano War of 1865-1866. World History at KMLA. Hämtad 18 december 2007.
- ↑ Cooney R, Jepson P (2006). "The international wild bird trade: what's wrong with blanket bans?" Oryx 40 (1): 18–23. PDF
- ↑ Manzi M (2002). "Cormorant fishing in Southwestern China: a Traditional Fishery under Siege. (Geographical Field Note)." Geographic Review 92 (4): 597–603.
- ↑ Pullis La Rouche, G. (2006). Birding in the United States: a demographic and economic analysis. Waterbirds around the world. Eds. G.C. Boere, C.A. Galbraith & D.A. Stroud. The Stationery Office, Edinburgh, UK. pp. 841–46. PDF
- ↑ Chamberlain DE, Vickery JA, Glue DE, Robinson RA, Conway GJ, Woodburn RJW, Cannon AR (2005). "Annual and seasonal trends in the use of garden feeders by birds in winter." Ibis 147 (3): 563–75. PDF
- ↑ Routledge S, Routledge K (1917). "The Bird Cult of Easter Island." Folklore 28 (4): 337–55.
- ↑ Chappell J (2006). "Living with the Trickster: Crows, Ravens, and Human Culture." PLoS Biol 4 (1):e14. doi:10.1371/journal.pbio.0040014
- ↑ Hauser A (1985). "Jonah: In Pursuit of the Dove." Journal of Biblical Literature 104 (1): 21–37. doi:10.2307/3260591
- ↑ Nair P (1974). "The Peacock Cult in Asia." Asian Folklore Studies 33 (2): 93–170. doi:10.2307/1177550
- ↑ Tennyson A, Martinson P (2006). Extinct Birds of New Zealand Te Papa Press, Wellington ISBN 978-0-909010-21-8
- ↑ Meighan C (1966). "Prehistoric Rock Paintings in Baja California." American Antiquity 31 (3): 372–92. doi:10.2307/2694739
- ↑ Clarke CP (1908). "A Pedestal of the Platform of the Peacock Throne." The Metropolitan Museum of Art Bulletin 3 (10): 182–83. doi:10.2307/3252550
- ↑ Boime A (1999). "John James Audubon, a birdwatcher's fanciful flights." Art History 22 (5) 728–55. doi:10.1111/1467-8365.00184
- ↑ Chandler A (1934). "The Nightingale in Greek and Latin Poetry." The Classical Journal 30 (2): 78–84.
- ↑ Lasky E (1992). "A Modern Day Albatross: The Valdez and Some of Life's Other Spills." The English Journal, 81 (3): 44–46. doi:10.2307/820195
- ↑ Enriquez PL, Mikkola H (1997). "Comparative study of general public owl knowledge in Costa Rica, Central America and Malawi, Africa." Pp. 160–66 In: J.R. Duncan, D.H. Johnson, T.H. Nicholls, (Eds). Biology and conservation of owls of the Northern Hemisphere. General Technical Report NC-190, USDA Forest Service, St. Paul, Minnesota. 635 ss.
- ↑ Lewis DP (2005). Owls in Mythology and Culture. The Owl Pages. Hämtad 15 september 2007.
- ↑ Dupree N (1974). "An Interpretation of the Role of the Hoopoe in Afghan Folklore and Magic." Folklore 85 (3): 173–93.
- ↑ Fuller E (2000). Extinct Birds (2:a upplagan). Oxford University Press, Oxford, New York. ISBN 0-19-850837-9
- ↑ Steadman D (2006). Extinction and Biogeography in Tropical Pacific Birds, University of Chicago Press. ISBN 978-0-226-77142-7
- ↑ Birdlife International (2007). [http://www.birdlife.org/news/news/2007/05/2007_red_list_update.html 1,221 and counting: More birds than ever face extinction.] Hämtad 3 juni 2007.
- ↑ Norris K, Pain D (red.) (2002). Conserving Bird Biodiversity: General Principles and their Application Cambridge University Press. ISBN 978-0-521-78949-3
- ↑ Brothers NP (1991). "Albatross mortality and associated bait loss in the Japanese longline fishery in the southern ocean." Biological Conservation 55: 255–68.
- ↑ Wurster D, Wurster C, Strickland W (1965). "Bird Mortality Following DDT Spray for Dutch Elm Disease." Ecology 46 (4): 488–99. doi:10.1126/science.148.3666.90
- ↑ Blackburn T, Cassey P, Duncan R, Evans K, Gaston K (2004). "Avian Extinction and Mammalian Introductions on Oceanic Islands." Science 305: 1955–58. doi:10.1126/science.1101617
- ↑ Butchart S, Stattersfield A, Collar N (2006). "How many bird extinctions have we prevented?" Oryx 40 (3): 266–79 PDF
Övriga källor
- Flyttfåglar, Jacques Perrin & Jean-François Mongibeaux (2003) ISBN 91-7054-968-0
- Fågelguiden, Killian Mullarney, Lars Svensson & Dan Zetterström (1999) ISBN 91-34-51038-9
- Kunskapen om fåglar, Tage Wahlberg (1993) ISBN 91-29-61772-3
- Skydda fåglarna, Rudolf Schreiber, Anthony W. Diamond, Sven G. Nilsson, Staffan Ulfstrand (1987) ISBN 91-7886-029-6
- Tracks & Signs, Roy Brown, John Ferguson, Michel Lawrence & David Lees (2003) ISBN 0-7136-5382-5
- Fåglarnas evolutionära historia kartlagd, intervju med Per Ericson, docent vid Naturhistoriska riksmuseet i Stockholm, Tidningarnas Telegrambyrå, 2006-09-19
- Stafan Ulfstrand, Jordens fågelfauna - ett Newtonskt försök till överblick, Vår Fågelvärld, #2, 2004.
Externa länkar
- Sveriges Radio: P2-fågeln
- GlobalTwitcher.com - Alla världens fågelarter och raser med bilder och utbredning
- Fåglars taxonomi
- AERC TAC's Taxonomic Recommendations (1 December 2003)
- Familjennamn på svenska - EuroBirdNet Sweden
- Holarktis fåglar - Svenskt, vetenskapligt och engelskt namn
- Rapporteringssystemet för fåglar, kallat Svalan
- Guiness world records
- Club 300
- Birds.se - Bilddatabas med över 4000 bilder på mer än 470 fågelarter.
- - Lista med bilder från Birds.se
- - Bilder på fåglar
- - Fågelbilder Fågelfoto + Fågelläte






.jpg)