Dygnsrytm
Från Rilpedia
Dygnsrytmer eller cirkadianska rytmer (från latinets circa dies, "ungefär en dag"), är de processer hos levande organismer, som är inbyggda och regelbundet cykliska med en period av ungefär ett dygn. Sådana rytmer finns hos ett mycket stort antal organismer, från enkla organismer som cyanobakterier[1], till svampar[2], växter[3] och djur. Dessa inre biologiska klockor styr ett antal andra processer, som ämnesomsättningen, födointaget och växlingar mellan vila och aktivitet.
Centrala egenskaper hos dygnsrytmer är att de har en periodlängd på cirka ett dygn och att de kan anpassa sig efter intryck från omgiviningen, så kallade zeitgebers, men även fortgå om organismen befinner sig i en miljö utan dem, genom att organismen själv fortsätter att generera signalerna autonomt, så kallad free-running.
Innehåll
|
Grundläggande egenskaper hos cirkadianska rytmer
Även om den biologiska bakgrunden varierar mellan olika organismer, har dygnsrytmen vissa egenskaper som är gemensamma hos många olika arter. De närmare mekanismerna bakom urverket kan också variera (se mer om detta nedan), men går hos djur, växter och svampar ut på att celler avläser (transkriberar) en en eller flera "daggener" och och producerar proteiner enligt instruktionen. Dessa proteiner får cellen att öka mängden av andra proteiner. Dessa proteiner hämmar i sin tur bildningen eller aktiviteten hos de förstnämnda proteinerna. Cellens koncentration av de olika proteinerna kommer att pendla fram och tillbaka. Den exakta periodlängden kan variera något beroende på art, men ligger vanligen mellan 22 och 25 timmar. Då de olika klockproteinerna påverkar andra processer i cellen kommer deras pendling att skapa en dygnsrytm.
Eftersom det är en inre process som fortgår av sig själv behöver organismen inga signaler från omgivningen för att följa sin egen rytm. Klockproteinerna kan dock (indirekt) påverkas av externa stimuli, så kallade zeitgebers (tyska för tidgivare). Den process genom vilken externa stimuli ställer om dygnsrytmen kallas för entrainment (synkronisering).
Vilka externa stimuli som kan fungera som zeitgebers är olika för olika arter, men den viktigaste och kanske mest kända för de flesta arter är ljus.[4] Andra zeitgebers är till exempel temperaturförändringar[5] och sociala stimuli (jämför väckarklocka). En annan intressant egenskap hos de så kallade inre klockorna hos olika organismer, som man inte fullt förstår, är att de inte påverkas av pH eller djurets kroppstemperatur (förändringar i omgivningstemperaturen kan alltså hos vissa arter signalera till organismen när det blir morgon respektive kväll, men trots att så gott som alla kända kemiska reaktioner går snabbare vid ökande temperatur bibehåller dygnsrytmen sin rytmicitet oberoende av organismens egen temperatur och pH).[6]
Periodlängd (τ), fas (Φ) och fasrespons
En cirkadiansk rytm kännetecknas av att den har en bestämd periodlängd, det vill säga att varje upprepning tar en viss tid. Periodlängden betecknas ofta med den grekiska bokstaven tau (τ), och är för de flesta organismer ungefär 24 timmar. Om en organism hålls i konstanta förhållanden, det vill säga med en konstant ljusmängd och temperatur dygnet runt, kommer djuret att följa ett dygn vars längd beror på dess inre klockas egen periodlängd. Med tiden kan således organismens inre klocka successivt avvika allt mer från den verkliga tidens förlopp.
Eftersom den biologiska klockan skapas genom att gener turas om att undertrycka varandra så ligger det nära till hands att försöka avla fram organismer som har en inre klocka med längre eller kortare periodlängd. Man kan även manipulera τ hos en organism med läkemedel eller hormoner som påverkar klockproteinerna, eller genom att manipulera miljön organismen befinner sig i.[7] Organismens ålder påverkar också periodlängden hos den inre klockan. Hos vissa organismer, exempelvis människor, förkortas τ med ökande ålder[8][9] medan τ hos andra organismer, till exempel möss, istället förlängs med ökande ålder.[10] Det är också möjligt att förändra τ genom att i laboratoriemiljö utsätta organismer för artificiella dygn som är kortare eller längre än 24 timmar. Kackerlackor som exponeras för 22-timmarsdygn utvecklar kortare periodlängd än kackerlackor som exponeras för 26-timmarsdygn, och dessa effekter kan kvarstå under lång tid efter att experimentet är avslutat.[11][12]
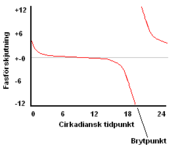
Den tidpunkt på den inre klockan då organismen förväntar sig att en viss vald händelse (exempelvis att solen går upp eller ner) ska äga rum kallas för en fas, och brukar betecknas med den grekiska symbolen phi (Φ). Eftersom pendlingen mellan de olika klockproteinerna inte går på exakt 24 timmar, och tidpunkten för solens upp- och nergång beror på olika faktorer och dessutom kan variera under året, måste den inre klockan kunna ställa om sig som reaktion på yttre signaler. Dessa yttre zeitgebers kan förskjuta pendlingens fas (det vill säga vilket "klockslag" organismens inre klocka står på) antingen framåt eller bakåt. Hur en zeitgeber påverkar den inre klockan, det vill säga om den inre klockan ställs fram eller vrids tillbaka, beror på under vilken fas organismen exponeras för zeitgebern (se figur).
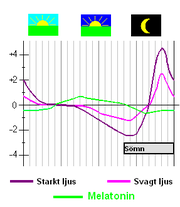
Sambandet mellan den fas då en organism exponeras för en zeitgeber och hur fasen påverkas kan också uttryckas grafiskt som en så kallad fas-respons-kurva (PRC, phase response curve). Hur kraftigt en zeitgeber påverkar dygnsrytmen beror alltså dels på vid vilken fas i sin dygnsrytm organismen utsätts för zeitgebern, och dels dess intensitet. Ju intensivare en zeitgebersignal är, desto mer kommer klockproteinerna och därigenom dygnsrytmen att påverkas av den. Starkt ljus har alltså förmågan att vrida den inre klockan mer än svagt ljus.[13]
Under en stor del av den subjektiva dagen (det vill säga den tid som den inre klockan tror är dag), kommer ljus inte att leda till någon fasförskjutning alls. Det symboliseras i fasresponskurvan av att linjen ligger nära 0-strecket. Även om någon tydlig fasförskjutning inte sker, verkar ljus mitt på dagen ändå ha en viss betydelse för dygnsrytmen. Ljus på den subjektiva kvällen och förnatten kommer att vrida tillbaka den inre klockan, medan ljus på den subjektiva efternatten kommer att vrida den framåt.[13][14]
Stark och svag fasförskjutning: Typ 0- respektive typ 1-respons
Fasresponskurvor kan ha två principiellt olika utseenden, beroende på organism och på zeitgeberstimulits intensitet (exempelvis ljusstyrka om man använder ljus som zeitgeber). Man skiljer således mellan typ 0-fasresponskurvor och typ 1-fasresponskurvor. Typ 1-fasresponskurvor kännetecknas av att dygnsrytmens reaktion på en zeitgeber är förhållandevis liten (ett par timmar som mest). Ett exempel på en typ 1-fasresponskurva kan ses ovan. En typ 0-fasresponskurva å andra sidan kännetecknas av att det två gånger per cirkadianskt dygn finns en tidpunkt där klockproteinernas koncentrationer är i jämvikt med varandra. När klockproteinerna turas om att öka och minska måste de ju mötas på mitten nånstans. En zeitgeber som levereras vid jämviktspunkten kan skifta dygnsfasen så att klockproteinet som var på väg upp går ner och det som var på väg ner går upp. Den kan alltså förskjuta dygnsrytmen med upp till 12 timmar framåt eller bakåt. Om en organism reagerar med typ 0-respons eller typ 1-respons beror dels på vilken art organismen tillhör, men också på stimulits intensitet. Genom att öka stimulusintensiteten, exempelvis ljusstyrkan om man använder ljus som zeitgeber, kan man få en organism som normalt uppvisar en typ 1-fasresponskurva för ljus att reagera med en typ 0-respons istället.[15] En studie har funnit att människor, som exponeras för starkt ljus vid tre dygn i följd på morgonen, kan svara med en så kallad stark fasförskjutning, det vill säga en typ 0-respons.[16]
Fasvinkel (ψ)
Den subjektiva, eller cirkadianska, tiden (det vill säga den tid på dygnet som organismens inre klocka tror att det är) kan stämma mer eller mindre väl överens med den objektiva tiden på dygnet. Det tydligaste exemplet på när den cirkadianska och den objektiva dygnsfasen skiljer sig åt är kanske jetlag. Skillnaden i cirkadiansk tidpunkt och objektiv tidpunkt kan uttryckas antingen i ungefärligt antal timmar eller som en så kallad fasvinkel, det vill säga ett gradtal. Skillnaden mellan cirkadiansk och objektiv tidpunkt betecknas med den grekiska bokstaven psi (ψ). Om man uttrycker ψ som ett gradtal, avser ψ på 180° en skillnad mellan subjektiv och objektiv fas på 12 timmar.
Entrainment och zeitgebers
Ljus som zeitgeber
Ljus är kanske den zeitgeber som har mest universell effekt. Det fungerar som zeitgeber på så gott som alla studerade organismer, inklusive sådana som lever i konstant mörker.[17] Organismen känner av ljus i omgivningen med hjälp av ett ljuskänsligt pigment, som antingen finns i näthinnan (hos ryggradsdjur) eller i andra celler (hos insekter och växter). Växter har tre olika klasser av ljuskänsliga pigment förutom klorofyll, nämligen fytokromer, som framför allt är känsliga för rött ljus[18], men även lite för blått [19], kryptokromer, som framför allt är känsliga för blått ljus men som också används som signalmolekyler för att signalera till växten när fytokromerna fångar upp ljus[20], och fototropiner, som inte är inblandade i själva dygnsrytmregleringen utan styr växternas fototropism, det viss säga deras benägenhet att rikta sig mot en ljuskälla. Växten reglerar sin egen ljuskänslighet under dygnet, genom att bildandet av fytokromer och kryptokromer inte är konstant under dygnet utan högst på morgonen och några timmar därefter. Det gör att det är då som känsligheten för ljus är som störst.[21]
Hos djur särskiljer sig däggdjur från övriga djur vad gäller känsligheten för ljus i det att de celler som härbärgerar den inre klockan inte själva är känsliga för ljus, utan att särskilda strukturer i ögat tar emot information till den inre klockan. Hos groddjur, leddjur, fiskar och fåglar är celler som är känsliga för ljus och kan styra den inre klockan inte enbart lokaliserade till näthinnan.[4] Hos bananflugor och zebrafiskar är det till och med så att enskilda celler från olika delar av kroppen inte bara har en egen dygnsrytm som är oberoende av resten av organismens (det vill säga att om man tar celler från en bananfluga och transplanterar till en annan bananfluga med en annan dygnsrytm kommer de transplanterade cellerna att behålla sin ordinarie dygnsrytm[22]), utan de enskilda cellerna är också känsliga för ljus och kan ställa om sin dygnsrytm efter det[23]. Den ljuskänslighet som de enskilda cellerna har, och som alltså inte kräver något öga för att ta emot ljus, kommer sannolikt från kryptokromer, åtminstone verkar det vara fallet hos zebrafiskar.[24] Hos däggdjur, däremot, har man inte kunnat påvisa någon direkt ljuskänslighet hos klockor i perifer vävnad, även om även däggdjur har klockor i olika celler i kroppen.[4]

Hos däggdjur kommer istället ljusintryck enbart via ögat, och tas emot av särskilda pigmentinnehållande celler i näthinnan. Dessa celler är inte de vanliga tapparna och stavarna, vilka tar emot syninformation, utan andra celler, speciellt avsedda just för att förse den inre klockan med information om ljus. Det har under början av 2000-talet rått delade meningar om huruvida detta pigment är kryptokrom eller det med tapparnas färgpigment besläktade melanopsin. Båda pigmenten uttrycks i celler i näthinnan[25][26] och båda har i studier där man inaktiverar eller avlägsnar dem hos försöksdjur visat sig kunna störa försöksdjurets känslighet för ljus som zeitgeber.[27][28] Melanopsin absorberar dock ljus inom den del av spektret som man vet mest effektivt påverkar dygnsrytmen[29], och dessutom är det just de melanopsininnehållande cellerna i näthinnan som har kontakt med nucleus suprachiasmaticus[30], den del av hjärnan från vilken dygnsrytmen styrs hos däggdjur. Även de vanliga syncellerna, det vill säga de tappar och stavar som används för själva seendet, kommunicerar indirekt med de melanopsininnehållande cellerna som i sin tur kommunicerar med den inre klockan i nucleus suprachiasmaticus.[31]
Temperaturförändringar som zeitgeber
Förändringar i omgivningstemperatur kan också ställa om den inre klockan hos ett flertal olika arter.[32] Mest känsliga är poikiloterma (kallblodiga) djur.[7] Det verkar finnas flera olika mekanismer för hur temperaturförändringar påverkar dygnsrytmen hos olika organismer. Bland annat kan det ske genom att påverka nedbrytning[33] och transkription av olika proteiner som är inblandade i själva klockmekanismen (se nedan) eller genom att ändra antalet fosfatgrupper som är bundna till klockproteinerna och även andra egenskaper hos dessa.[32] Hos ett flertal alger och växter har man funnit att pulser med högre eller lägre temperatur än omgivningstemperaturen kan ställa om den inre klockan.[32] Både stark och svag fasrespons (se ovan) som resultat av temperaturpulser har observerats.[34] Den exakta mekanismen för hur temperaturförändringar leder till entrainment är inte känd för alla organismer. Hos svampen Neurospora crassa har man främst intresserat sig för ett protein som benämns FRQ (FREQUENCY), som finns i två olika varianter, och där proportionerna mellan de två varianterna är temperaturberoende. Vissa studier[35] har tagits som stöd för den här hypotesen, men andra studier har antytt att det kan vara mer komplicerat än så,[36] och mycket talar för att FRQ-proteinet har någon annan roll än just att ställa om klockan utifrån temperaturförändringar.
Även växter är känsliga för temperatur.[37] Mekanismen är inte känd. Om man hos backtrav stänger av generna PRR7 och PRR9 (Pseudo-Response Regulator 7 resp 9) förlorar växter förmågan att reagera på temperatur,[38] men växternas dygnsrytm störs på flera andra sätt också, som inte har direkt med temperaturkänslighet att göra. Det kan tala för att PRR7 och PRR9 sannolikt har någon mer central funktion mer "nedströms".[39] Växter kan känna av kraftiga variationer i temperatur genom att det påverkar cellmembranets egenskaper och aktiviteten hos olika enzymer och jonkanaler genom cellmembranet genom vilka kalciumjoner kan flöda in och ut ur cellen.[32] Man vet att just temperaturberoende in- och utflöde av kalciumjoner delvis styr gener hos växter som har att göra med tolerans för låga temperaturer,[40] men det är osäkert om det är detta som styr även temperaturkänsligheten för dygnsrytmer. Man har också föreslagit att gibberellinsyra, ett hormon som växter använder för att styra bland annat tillväxt och groning, kan vara inblandat i växternas förmåga att känna av temperatur.[37][41]
Leddjur, både insekter[42] och kräftdjur,[43] är också känsliga för temperaturförändringar som zeitgeber. Hos fruktflugor styr bland annat temperaturförändringar via dygnsrytmen när de vuxna flugorna kommer ut ur sina puppor.[44] Även fruktflugors vilo- och aktivitetsrytm under dygnet kan styras med hjälp av rytmiska temperaturförändringar.[32]
Hos ryggradsdjuren är det framför allt de kallblodiga djuren som är känsliga för temperatur. Ett problem i många studier på kallblodiga djur är att temperatur dels verkar ha effekten att ställa om klockan och dels verkar ha effekten att i sig själv påverka insöndringen av mörkerhormonet melatonin, som är en markör som ofta används i dygnsrytmstudier.[32] Det är allmänt känt, även från andra organismer och då andra zeitgebers studeras, att en zeitgebersignal förutom att ställa om klockan kan ha en "akut" effekt på studerade parametrar. Man har dock funnit att pulser av låg temperatur kan ställa om klockan hos bland annat ödlor.[45] Hos varmblodiga djur är temperatureffekterna mindre uttalade, och det föreligger större skillnader mellan olika individer i känslighet för temperatur.[32] Hos påsmöss, som är heteroterma, ser man dock en tydligare förmåga att svara på temperaturförändringar.[46] Om detta är specifikt för just påsmöss, eller om det gäller allmänt för heteroterma djur att de är mer känsliga för temperaturförändringar är inte känt. Man har däremot föreslagit att temperatur kan användas av både varm- och kallblodiga djur som ett eget sätt att styra sin dygnsrytm och framför allt att samordna de olika klockor som finns i olika delar av organismen (flercelliga djur har inte endast en klocka, utan enskilda celler även utanför den del av hjärnan som är säte för själva "huvudklockan" kan ha egna klockor). Man har föreslagit att djur genom att antingen via förändrat beteende (hos poikiloterma djur) eller genom hormoner (hos endoterma djur) påverkar sin kroppstemperatur, och att detta i sin tur kan användas som en signal som kan styra den inre klockan.[32] Även om endoterma djur inte är lika känsliga som poikiloterma djur för förändring av den yttre temperaturen (de effekter som beskrivits på dygnsrytmen är vanligen små) har de kvar en känslighet för temperatur, vilket bland annat visas av att det går att fasförskjuta dygnsrytmen i odlade nervceller från den inre klockan hos råttor genom att utsätta cellerna för värmepulser.[47]
Sociala stimuli som zeitgeber
Med sociala stimuli menar man interaktion med andra individer, antingen av samma art eller av en annan art. Det kan till exempel röra sig om andra flockmedlemmar hos flockdjur eller om potentiella bytesdjur eller rovdjur. Sociala stimuli som zeitgeber har framför allt studerats hos däggdjur. Det är ett område som är förknippat med vissa forskningsmetodiska svårigheter: djurs beteende kan helt klart påverkas av andra djurs beteende, och en konsekvens av förändringar i djurs beteende är att deras exponering för solljus kan förändras. Det innebär att man i studier på något sätt måste skilja mellan om det är sociala stimuli som själva direkt påverkar dygnsrytmen, eller om sociala stimuli helt enkelt förändrar ett djurs beteende så att dess exponering för ljus förändras, och att det sedan är ljuset som påverkar dygnsrytmen.[48]
Hos många djur finns en mätbar dygnsrytm redan under fostertiden, som styrs via bland annat dopamin[49] och melatonin[50] från modern.[51] Efter födseln minskar djurens inre klocka sin känslighet för dopamin, och blir istället känslig för ljus.[52] Hos vissa gnagare, till exempel kaniner, behåller ungarna en känslighet för stimuli från modern. Nyfödda kaninungar befinner sig i bohålan hela dygnet och exponeras alltså inte för solljus. Modern besöker boet endast korta stunder för att ungarna ska kunna dia, och detta sker vid regelbundna tider på dygnet. Ungarna blir aktivare redan ett par timmar innan modern brukar komma, och den här periodiska aktivitetshöjningen vid den tidpunkt då modern brukar komma kvarstår i flera dygn, även om modern inte skulle dyka upp, vilket talar för att det är en sant cirkadiansk process.[48] Det är osäkert hur detta styrs, och det är inte ens säkert att förmågan att förutsäga födointag styrs via den suprakiasmatiska kärnan (se nedan).
Även vuxna djur påverkas av sociala stimuli. Hos vissa grottlevande fladdermusarter har man funnit att djur som hålls i en bur inne i grottan bibehåller sin dygnsrytm om andra, fria fladdermöss finns i samma grotta, men inte om de hålls under identiska förhållanden fast avskilda från sina artfränder.[48] Detta är dock ett strikt artspecifikt fenomen, och gäller inte alla fladdermusarter. Den exakta mekanismen för hur sociala stimuli påverkar den inre klockan är inte känd, men det finns två huvudsakliga hypoteser. Enligt den ena hypotesen, den så kallade arousalhypotesen, är det så att alla stimuli som påverkar ett djurs vakenhetsnivå har förmågan att påverka djurets dygnsrytm.[53][54]. Man tänker sig alltså att när de andra djuren är vakna kommer de att interagera med det enskilda djuret, och detta leder till en ökad vakenhetsnivå vilket i sin tur påverkar dygnsrytmen. En annan hypotes är att entrainment ser genom artspecifika doft- eller ljudsignaler. Deguer är till exempel känsliga för sociala stimuli som zeitgeber, en känslighet som försämras om man bränner bort luktcellerna i djurets nos.[55] Vidare verkar luktstimuli hos vissa djur påverka känsligheten för ljus, och därmed indirekt kunna ställa om klockan.[56] Hos fruktflugor verkar också luktsignaler vara inblandade i social reglering av dygnsrytm,[57] och här är bevisen starkare än för deguer, då flera av de studier som gjorts på deguer har metodologiska svagheter.[48]
Fysisk aktivitet som zeitgeber
Hos ett flertal däggdjur är också fysisk aktivitet en zeitgeber.[58] Huruvida det verkar via en allmän ökning av djurets vakenhetsgrad eller via någon annan mekanism är inte känt. Effekten är olika stor hos olika djurarter, och hamstrar är till exempel mycket känsligare än råttor. Hos människor kan också fysisk aktivitet vara en zeitgeber. Fysisk aktivitet på kvällen avancerar den inre klockan (den subjektiva kvällen kommer tidigare), medan fysisk aktivitet under natten och förmiddagen försenar den inre klockan (den subjektiva kvällen kommer senare).[59] Det är oklart om effekten beror på fysisk aktivitet direkt eller på indirekta effekter, såsom ändrad kroppstemperatur.
Födointag som zeitgeber
Just födointag som cirkadiansk zeitgeber har väckt en del intresse, eftersom dess effekter på organismer inte liknar övriga zeitgebers. Redan 1922 upptäckte man att råttor som ges mat vid regelbundna tider relativt snabbt lär sig att förutse när de kommer att få mat, och ökar sin fysiska aktivitet före den tidpunkt de brukar utfodras.[60] Denna aktivitetsökning benämns i litteraturen food anticipatory activity, och förkortas FAA. Om man skadar den del av hjärnan som styr dygnsrytmen hos däggdjur, den så kallade suprakiasmatiska kärnan, försvinner djurets dygnsrytm och djuret blir arytmiskt. Dock kvarstår fortfarande förmågan att förutsäga regelbundna måltider.[48] Även om djuret inte får någon mat kommer det fortfarande att visa ökad aktivitet vid den tid på dygnet där det fått mat tidigare.[61] Dygnsrytmen för matintag verkar därför styras från någon annan struktur. Man har också visat att djuren uppvisar en ökad aktivitet samma tid på dygnet i flera dygn även om de inte får mat, vilket tyder på att beteendet verkligen styrs av en inifrån genererad dygnsrytm.[62] Om nattaktiva råttor får mat på dagtid kommer de att börja bli aktiva strax innan mattillfället, trots att det är ljust och deras suprakiasmatiska klocka fortfarande är ställd på att det är dag.[63] En intressant egenhet hos dygnsrytmen för föda är att den bara ses när födotillgången är begränsad. Det verkar dock som att dygnsrytmen genereras även när födotillgången är obegränsad, men att det bara är vid begränsad födotillgång som den är kopplad till FAA-beteende.[61]
Man har i olika studier funnit att de proteiner som ingår i alstrandet av dygnsrytm i den suprakiasmatiska kärnan också uttrycks i andra celler, både i andra delar av hjärnan och i andra vävnader. Födointag vid bestämda tider styr uttrycket av dessa proteiner i olika delar av hjärnan (dock inte i den suprakiasmatiska kärnan) och levern.[63][64] Försök att förskjuta försöksdjurs dygnsrytm med ljus påverkar uttrycket av klockproteiner i levern om djuren har fri tillgång till föda, men inte om de bara har begränsad tillgång till föda och ges föda vid bestämda tidpunkter.[65] Eftersom mat når organismen via mag-tarmkanalen har det föreslagits att den inre klockan som styr FAA-beteende skulle sitta här. I en studie där man genmodifierat möss så att de uttryckte proteinet luciferas, ett ljusalstrande protein som bland annat finns hos eldflugor samtidigt som de uttryckte proteinet PERIOD (ett protein inblandat i alstrandet av dygnsrytmer, se mer nedan), så kunde man se att levercellerna relativt snabbt ställde in sin dygnsrytm efter mattiderna, och att även cellerna från lungorna till viss grad påverkades i sin dygnsrytm av måltider, men att cellerna i den suprakiasmatiska kärnan inte påverkades alls. Även hos råttor som har gjorts cirrotiska med hjälp av levergiftet koltetraklorid behåller dock sin förmåga att förutsäga regelbundna födointag, trots att deras leverfunktion för övrigt är svårt skadad.[66]
Ett flertal studier har genomförts där man skadat olika delar av hjärnan hos försöksdjur för att se om de behåller sin födorelaterade dygnsrytm, med varierande och delvis motstridiga resultat. Detta har fått vissa att föreslå att FAA inte alstras av en specifik struktur i hjärnan eller ett specifikt organ i kroppen, utan genom ett samspel mellan olika delar av hjärnan.[67] Den mekanism genom vilken födointag påverkar dygnsrytmen är inte känd, och det finns också en del fynd som tyder på att den molekylära mekanism genom vilken magtarmkanalens dygsnrytm alstras delvis skiljer sig från den genom vilken hjärnans dygnsrytm alstras.[68]
Interaktion mellan olika zeitgebers
Hos insekter i nordliga klimat, där det kanske är ljust hela tiden, är temperatur en viktigare zeitgeber än ljus.[44] Hos lägre stående djur kan temperatur vara viktigare än ljus (se ref i Ruby (1999).
Evolution
Man tänker sig att förmågan att på något sätt själv hålla koll på tiden med en inre klocka är relativt gammal, och att den utvecklats i en miljö där någon viktig omgivningsfaktor har varierat beroende på tid på dygnet. En sådan faktor som har föreslagits är ultraviolett ljus[69] framför allt under prekambrium då atmosfären inte hade något skyddande ozonskikt.[70] Vattenlevande smådjur går ofta ner till djupare vatten dagtid, och man har funnit att de gör detta som en reaktion på ultraviolett ljus,[71] möjligtvis då ultraviolett ljus är skadligt för DNA. Vidare finns det så stora molekylära likheter mellan ett enzym för att reparera UV-orsakade mutationer och kryptokrom, ett av de fotopigment som anses vara inblandat i signalvägarna genom vilka ljus kan påverka dygnsrytmen (se nedan), att man tänker sig att kryptokrom helt enkelt evolutionärt har utvecklats ur DNA-reparerande enzymer.[69] En hypotes är således att det allra tidigaste exemplet på dygnsrytm var just hos små vattendjur, som genom dygnsrytm hade förmågan att förutse soluppgång och därmed ökad mängd UV-strålning. Vidare verkar det som att utvecklingen av ljuskänsliga kryptokromer ur DNA-reparerande enzymer skett flera gånger under evolutionen: både djur och växter har nämligen kryptokromer som har stor likhet med DNA-reparerande enzymer, men kryptokromerna hos djur verkar ha utvecklats ur delvis andra enzymer än kryptokromerna hos växter. De kryptokromer som växter har, utvecklades troligen innan växter och djur började skilja sig åt evolutionärt, men har sedan förlorats hos djur.[19]
Förmågan att hålla reda på tiden på dygnet har en mängd evolutionära fördelar hos ett flertal olika organismer. Hit hör till exempel minskad risk att falla offer för rovdjur, beroende på att djuren håller sig mer stilla under sin viloperiod,[72][73] vidare samordning mellan hanar och honor inom en art för när de ska para sig[74] samt fåglars och andra djurs flyttning och vinterdvala.[6] Sannolikt har dock dygnsrytmen även andra funktioner, eftersom man har hittat system för att hålla reda på tid på dygnet även hos organismer som lever i grottor i konstant mörker.[75][17] Även bananflugor som levt under flera hundratals generationer i mörker kan behålla förmågan att reagera på ljuspulsar med att skifta tiden framåt eller bakåt i sin interna klocka,[6] vilket talar för att den inre klockan har någon annan uppgift förutom att anpassa djuret till en omgivning med dagar och nätter. Man har tänkt sig att denna funktion till exempel kan vara att koordinera inre biologiska och biokemiska processer, även om det ännu enbart får betraktas som en hypotes.
Oavsett vilken den grundläggande drivkraften har varit bakom utvecklingen av dygnsrytmen föreställer man sig att evolutionen gått till genom att det från början funnits flera olika inre klockor med olika periodlängd, men att vissa sedan "rensats ut" eftersom de inte passat överens med längden på det ordinarie dygnet, så att endast de funnits kvar som har haft en periodlängd på cirka 24 timmar. Denna teori, den så kallade resonansteorin, har fått stöd i viss forskning[76] men inte i annan.[77] Dock måste man ha i åtanke att Klarsfeld och Rouyer undersökte livslängden hos bananflugor, vilket inte är det samma som reproduktiv förmåga, och det är ju den reproduktiva förmågan som anses driva evolutionen.[78] Att skillnaden i överlevnad inte beror på eventuella andra funktioner hos de proteiner som alstrar dygnsrytmen utan är en effekt just av att organismens egen dygnsrytm inte stämmer överens med omgivningens dygn, har visats i studier på moskiter, där ickemuterade moskiter fötts upp i fångenskap där man experimentellt har kunnat variera dygnslängden mellan 24 och 26 timmar. Man såg då att de moskiter som levde under dygn som hade en längd som var nära en multipel av 24 timmar fick mer avkomma än de som levde med en dygnsrytm på 35 timmar.[79]
Om man jämför de gener och de mekanismer som styr alstrandet av dygnsrytmer hos olika organismer finner man relativt stora skillnader, så stora att man antar att dygnsrytmer har utvecklats oberoende av varandra vid flera tillfällen i evolutionen.[80] Det är relativt enkelt att teoretiskt skapa en klockmekanism, det vill säga en biokemisk process som oscillerar med en bestämd periodlängd. Trots detta är dock de flesta klockor betydligt mer avancerade än vad de "borde" behöva vara. Traditionellt har man förklarat det med att det gör klocksignalen mer stabil och mindre lättstörd av tillfälliga förändringar i omgivningen.[81]
Hos fotosyntetiskt aktiva prokaryoter finns det tre kända klockgener, nämligen kaiA, kaiB och kaiC, där kai är en förkortning för kaiten, det japanska ordet för att oscillera. Hos vissa bakterier alstras dygnsrytmen av kaiB och kaiC, medan hos andra alstras den av alla tre kai-proteinerna tillsammans. KaiC är det evolutionärt äldsta proteinet, och förutom hos cyanobakterier finns det också hos en del andra bakterier samt bland arkéer. Hos cyanobakterierna utvecklades sedan kaiB, som sedan spreds horisontellt till enstaka andra bakterier och arkéer. KaiA existerar endast hos cyanobakterier.[82] Det är omdiskuterat när de första dygnsrytmerna uppstod, men kai-generna hos cyanobakterier utvecklades för mellan 3,8 och 3 miljarder år sedan[82] och man har hittat korallfossiler som är cirka 400 miljoner år gamla i vars skelett man kan se tillväxtringar som följer ett cirkadianskt mönster.[83]
Man tänker sig att klockgenerna hos enklare organismer, som inte borde ha nytta av att veta vilken tid på dygnet det är, ändå kan medföra ett överlevnadsvärde för de organismer som har dem. Flera hypoteser har framlagts om vari detta överlevnadsvärde skulle ligga. En hypotes är den ovan föreslagna om att vissa organismer utvecklat förmågan för att undvika DNA-skadande effekter av solljus. Cellcykeln hos flercelliga organismer är kopplad till dygnsrytm, och cellernas känslighet för UV-strålning är också kopplad till dygnsrytm.[84] En annan hypotes är att dygnsrytmen har utvecklats i samband med att syrehalten i atmosfären ökade, för att reaktioner som var känsliga för fotooxidering skulle kunna äga rum.[78] Hos de flesta cyanobakterier är kvävefixering en syrekänslig reaktion eftersom enzymet som fixerar kväve inaktiveras av syrgas. En möjlig uppkomstmekanism för fotosyntes hos cyanobakterier har därför föreslagits vara att tidsmässigt kunna separera kvävefixering från den syreproducerande fotosyntesen.[85] Även hos brödmögelsvampen Neurospora crassa, har en dygnsrytm som styr dess reproduktion. En hypotes är att detta har utvecklats för att synkronisera svampens reproduktionsbenägenhet med aktiviteten hos vissa djur, som behövs för att sprida svampen.[86]
Bland djur är den bakomliggande mekanismen bakom dygnsrytm någorlunda väl konserverad, men med en del skillnader, framför allt mellan insekter och ryggradsdjur. En sådan skillnad är att flera av klockgenerna har duplicerats, så att däggdjur många gånger har flera olika varianter av gener som hos insekter bara finns i en variant.[87] Genen för kryptokrom, den så kallade CRY-genen, finns både hos insekter och däggdjur, men har lite olika funktion. Hos däggdjur finns flera CRY-gener, och CRY är direkt inblandad i alstrandet av dygnsrytm, vilket den inte är hos till exempel fruktflugor. Dock finns det andra insektsgrupper, till exempel humlor, som har två versioner av CRY-genen, varav den ena liksom hos däggdjur är inblandad i själva klockmekanismen.[88] Man tänker sig att duplikationer av CRY-genen skett innan insekter och ryggradsdjur skilt sig åt, och att det sedan skett deletioner hos vissa insektsarter. Även om det dock till stor del är samma gener som är inblandade i alstrandet av dygnsrytmsignalen hos insekter och ryggradsdjur, har de delvis fått olika funktioner. En gen som har en funktion hos bananflugor, kan alltså ha en helt annan funktion hos ryggradsdjur.[89]
En vidare evolutionär förändring bland ryggradsdjur är utvecklingen av melatonin, ett mörkerhormon vars biologiska effekt varierar mellan olika organismer men som produceras under den cirkadianska natten, det vill säga då organismen är inställd på att det är natt, oavsett om organismen är dag- eller nattaktiv. Melatonin produceras i särskilda celler, som kallas för pinealocyter. Hur dessa är anatomiskt organiserade varierar mellan olika organismer, men evolutionärt tros de ha utvecklats ur samma celltyp som också gav upphov till de ljuskänsliga cellerna i näthinnan.[90] Omvandlingen av ljus till kemiska signaler i fotoreceptorer bygger på ljusets förmåga att ändra strukturen hos retinaldehyd, och retinaldehyd kan reagera med vissa andra i kroppen förekommande kemiska substanser, nämligen arylalkylaminer som bildas vid nedbrytning av aromatiska aminosyror och bilda olika giftiga biprodukter. Denna benägenhet hos retinaldehyd att reagera med arylalkylaminer kan också leda till att mängden retinaldehyd minskar, genom att det som finns helt enkelt konsumeras i ofördelaktiga reaktioner, vilket leder till att synförmågan hos organismen försämras. Man tänker sig att detta har lösts evolutionärt tack vare två nya enzymer, nämligen arylalkylamin-N-metyltransferas (AANAT) och hydroxiindol-O-metyltransferas (HIOMT). Dessa kunde tillsammans omvandla arylalkylaminer till ofarliga restprodukter. En av de restprodukter som bildades var melatonin.[91] Genom att dela upp melatoninsyntesen och ljuskänsligheten i olika celler minskade vidare risken för att serotonin, en signalsubstans och tillika ett mellansteg i bildandet av melatonin, skulle reagera med retinaldehyd.[91][90]
Den biologiska klockans struktur och funktion
Dygnsrytmen alstras av en så kallad biologisk klocka, som kan se olika ut hos olika organismer men som bygger på ungefär samma grundprincip. Principen bakom klockan är antingen att ett antal gener kodar för proteiner som ökar eller minskar uttrycket av andra gener, och dessa påverkar sedan direkt eller indirekt uttrycket av de första generna, eller att proteiner får eller blir av med fosfatgrupper på ett oscillerande sätt, eller en kombination av dessa mekanismer. Denna grundmekanism kan sedan modifieras av inkommande signaler, till exempel ljus.
Den biologiska klockan hos cyanobakterier
Man trodde länge att cyanobakterier inte hade någon dygnsrytm, eftersom de delar sig mer än en gång per dygn och därför inte borde ha behov av det.[92] Man har dock funnit att cyanobakterier med en fungerande dygnsrytm utkonkurrerar cyanobakterier där man genetiskt tagit bort dygnsrytmen under normala förhållanden (det vill säga 12 timmars ljus och 12 timmars mörker som alternerar), trots att de cyanobakterier som saknar dygnsrytm växer snabbare i konstant ljus.[93] Om bakteriestammar med olika dygnsperiod får växa i kortare eller längre artificiella dygn kommer de bakterier vars cirkadianska period bäst överensstämmer med den yttre perioden att klara sig bäst.[76]
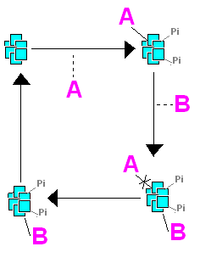
Exempel på processer som styrs cirkadianskt hos cyanobakterier är kvävefixering[94] och reproduktion.[95] Dessutom uttrycks så gott som alla gener cirkadianskt, delvis genom att cyanobakteriers kromosomer är olika tätt packade beroende på tid på dygnet, och det i sin tur styr transkription av olika gener.[96] Den exakta mekanismen för hur klockan fungerar är inte känd, men det finns ett antal olika hypoteser som alla kretsar kring en grupp proteiner som kallas kai. Ett av dessa proteiner, kaiC, kan binda till sig fosfatgrupper, och antalet fosfatgrupper det har bundit till sig varierar beroende på tid på dygnet.[97] KaiC som isolerat protein har inte fosfatgrupper. Däremot kan det interagera med proteinet kaiA, och när det gör så ändrar kaiC sin biologiska aktivitet och börjar binda till sig fosfatgrupper. Fosforylerat kaiC attraherar i sin tur proteinet kaiB, som hämmar kaiA:s effekt, så att kaiC genomgår en konformationsförändring och börjar göra sig av med fosfatgrupper. När kaiC blir av med fosfatgrupper minskar kaiB:s bindning till kaiC, och cykeln kan starta om. Hela denna cykel går på cirka ett dygn. Denna cykel kan fortgå även utan inblandning av gener, det vill säga att om man tillför de tre kai-proteinerna samt den biologiska fosfatkällan ATP till ett provrör, kommer fosforyleringen av kaiC att variera cykliskt under dygnet. Uttryck av gener är alltså inte nödvändiga för att denna biologiska klocksignal ska alstras hos cyanobakterier.[98] Förutom denna rytm som alstras av cyklisk fosforylering och defosforylering av kai utan inblandning av gener, verkar det också finnas en annan biologisk rytmhållande mekanism hos cyanobakterier. Även hos cyanobakterier där man muterar kaiC så att dess fosforylering störs fortgår nämligen en biologisk rytm.[99] Hur denna klockmekanism alstras är inte känt.
Den biologiska klockan hos svampar
Ett flertal svampar har en biologisk klocka, som framför allt har blivit studerad hos brödmögelsvampen Neurospora crassa. Den biologiska klockan hos svampar styr bland annat uttrycket av gener som har att göra med svampens skydd mot uttorkning och DNA-skador orsakade av solljus. Sådana gener börjar nämligen uttryckas tidigt på morgonen. Totalt har man upptäckt omkring 180 olika gener hos Neurospora som uttrycks dygnsrytmberoende.[100] Även sporbildningen är dygnsrytmberoende. Svampar är liksom djur eukaryota, (det vill säga deras celler har samma fundamentala uppbyggnad som djurceller, även om det också finns betydande skillnader), och den biologiska mekanism som styr klockan hos svampar liknar också den biologiska klocka som man finner hos djur. Grunden för de biologiska klockor man finner hos såväl svampar som växter och djur är proteiner som indirekt reglerar uttrycket av sig själva.
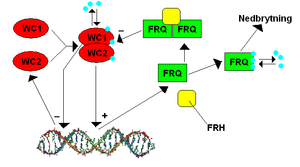
De hos Neurospora viktigaste proteinerna för dygnsrytmen heter FRQ (som står för frequency) och WC (som står för whitecollar). Det finns två stycken whitecollarproteiner, WC1 och WC2, som tillsammans bildar ett proteinkomplex som kallas WCC (Whitecollar complex). Om FRQ-genen muteras kan klockans period ändras,[101] och slås genen ut helt försvinner klockfunktionen och svampen blir arytmisk. Om WC-generna muteras kan svampen också bli arytmisk, eller bli av med sin känslighet för blått ljus (ljus är normalt en zeitgeber för neurospora). Det senare beror på att WC1 i kombination med vitaminet flavin är ljuskänsligt, och ljus får flavin att binda till WC1, vilket ger en formförändring hos WC1 som i sin tur ger proteinet en annan funktion. WC1 anses således ha betydelse för svampens ljuskänslighet.
Dygnsrytmen hos Neurospora genereras genom att WC1 och WC2 tillsammans bildar WCC, som fungerar som en transkriptionsfaktor som leder till att cellen börjar uttrycka proteinet FRQ. Detta sker under dagen, och under dagen når FRQ-mRNAt sin topp. Några timmar senare, på den subjektiva sena eftermiddagen, når FRQ-proteinet sin maximala koncentration.[102] Två FRQ-molekyler och en molekyl av enzymet FRH bildar tillsammans ett komplex som hämmar aktiviteten hos WCC. När WC1 ingår i WCC hämmar det dessutom transkriptionen av WC2, men när FRQ/FRH-komplexet hämmar WCC ökar transkriptionen av WC2. FRQ fosforyleras, det vill säga får fosfatgrupper påsatt på sig, av ett antal olika enzymer, och när FRQ fosforylerats till en viss nivå bryts det ner av cellen.[103] Den kombinerade effekten av nedbrytning av FRQ samtidigt som FRQ har hämmat WCC med minskad nybildning av FRQ som följd, medför att FRQ-halten i cellen minskar, och den når sin lägsta nivå runt midnatt.[104] Minskningen av FRQ leder till att WCC-aktiviteten ökar, och så kan cykeln börja om.
Den biologiska klockan hos växter
Den i växtriket mest studerade växten inom dygnsrytmforskningen är backtrav, Arabidopsis thaliana. Växter använder, liksom cyanobakterier, information om tid på dygnet bland annat för att styra sin fotosyntes.[105] Framför allt är förmågan att förutse dagen viktig om växten växer i en miljö där dagarna är korta.[106] Växter som växer i en miljö där daglängden varierar kraftigt under året har ofta en dygnsrytm som är betydligt mycket längre än 24 timmar. Detta antas bero på att organismer med en lång periodlängd är bättre på att anpassa sig till förändringar som när gryningen inträffar. Hos backtrav som växer vid en hög latitud har periodlängder upp mot över 28 timmar observerats.[107] En förlängd dygnsrytm leder också till försenad blomning, vilket minskar risken för att den blommande växten tar skada vid sena frostnätter.
Precis som hos svampar och djur (se nedan) bygger den biologiska klockan hos växter på ett antal sammankopplade oscillatorer, där proteiner på ett rytmiskt sätt direkt eller indirekt påverkar bildningen av sig själva.
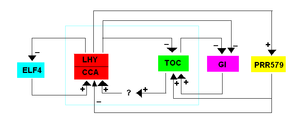
Den centrala loopen hos växter tros utgöras av proteinerna TOC1 (Timing of CAB1), LHY (Late elongated hypocotyl) och CCA1 (Circadian and clock associated 1). TOC1 är en transkriptionsfaktor som ökar växtcellens uttryck av en mängd olika gener, bland annat generna för LHY och CCA1. Dessa hämmar i sin tur uttrycket av TOC1. TOC1 bryts dessutom ner av cellen via proteinet ZTL (Zeitlupe). När TOC1 minskar, minskar också LHA och CCY1, och det leder till en ökning av TOC1. Denna ökning leder i sin tur till en ökning av LHA och CCY1, så att TOC1 slutar bildas. Detta är den centrala loopen, men det finns också åtminstone två andra: CCA1/LHY hämmar också andra gener, till exempel ELF4 (Early Flowering 4), som i sin tur liksom TOC1 ökar bildningen av CCA1/LHY, och CCA1/LHY ökar också uttrycket av en tredje grupp gener (PRR; Pseudo Response Regulators 5, 7 och 9) som i sin tur hämmar CCA1/LHY. Centralt i alla dessa oscillatorer verkar alltså CCA1 och LHY vara, och dessa påverkar sedan cellens uttryck av andra gener, vars produkter påverkar CCA och LHY på motsatt sätt. Den biologiska klockan hos växter är känslig för ljus och temperaturförändringar. Ett antal olika proteiner i klockan kan ha betydelse för ljuskänsligheten. Växter har flera ljuskänsliga pigment, som kan öka uttrycket av LHY och CCA1,[108] och även nedbrytningen av TOC1 kan hämmas av ljus.
Den biologiska klockan hos leddjur och blötdjur
Överlag är klockmekanismen relativt väl konserverad inom djurvärlden, det vill säga, skillnaderna i klockans struktur och funktion mellan leddjur och däggdjur är relativt små jämfört med skillnaderna mellan leddjur och växter eller svampar. Precis som hos alla kända organismer utom cyanobakterier bygger den inre klockan hos djur på att särskilda klockproteiner direkt eller indirekt hämmar uttrycket av sig själva, så att halten av dessa klockproteiner i cellerna oscillerar under dygnet. Till skillnad från alla ovan beskrivna organismgrupper finns dock bland leddjur och högre djur en särskild anatomisk struktur i nervsystemet med nervceller som är speciellt anpassade för att alstra en dygnsrytm.[109] Hos insekter styrs bland annat motorisk aktivitet, när på dygnet insekten tar sig ur puppan,[110] navigering efter solljus[111] och äggläggning.[112]
Hos blötdjur är dygnsrytmen framför allt studerad bland sjöharar och hos havssnigeln Bulla gouldiana. Hos båda dessa blötdjur har synnerven en viss spontanaktivitet, som varierar över dygnet och följer den inre klockan. Det är denna spontanaktivitet som mätts i studier. Själva cellerna som alstrar dygnsrytmen sitter hos båda dessa blötdjursarter i näthinnan, och dessa cellers vilomembranpotential varierar beroende på den inre klockan. Eftersom nervcellers benägenhet att skicka iväg nervsignaler beror på deras vilomembranpotential, kommer antalet nervimpulser i synnerven att bero på tiden på dygnet, och det är dessa nervimpulser som signalerar tiden på dygnet till resten av organismen.[113]
Hos insekter är bilden något mer komplex, eftersom olika insektsarter skiljer sig något mer åt vad gäller dygnsrytmens alstrande och sätet för centralklockan. Insektshjärnan består av två synlober och två cerebrallober. Hos kackerlackor och syrsor sitter klockan i synloben,[114] medan den sitter i cerebralloben hos till exempel silkesmaskar.[109] Den inre klockans signaler vidarebefordras sannolikt till resten av organismen via signalsubstansen PDF(Pigment Dispersing Factor).[115]
Den centrala oscillatorn som ligger bakom klocksignalen hos insekter alstras huvudsakligen genom att fyra proteiner interagerar med varandra. Dessa heter CLK (CLOCK), CYC (CYCLE), PER (PERIOD) och TIM (TIMELESS).[116] CLK och CYC kan binda till varandra och på så sätt bilda en transkriptionsfaktor; CLK:CYC.
Tidigt på morgonen aktiverar denna transkriptionsfaktor uttrycket av proteinerna TIM och PER. Initialt under dagen fosforyleras PER av enzymet DBT (DOUBLETIME) och bryts ner.[117] När halten av TIM ökar kan dock TIM och PER binda till varandra. Då TIM hämmas av ljus sker dock detta först vid mörkrets inbrott.[118] En viktig funktion hos TIM är att förhindra nedbrytning av PER. PER och TIM går in i cellkärnan där de binder till CLK:CYC-tranksriptionsfaktorn och hämmar denna. Det leder till en minskning av cellens uttryck av PER och TIM. Samtidigt kommer CLK:CYC att öka cellens uttryck av andra transkriptionsfaktorer, som i sin tur ökar uttrycket av CLK. Ökad mängd CLK och minskad mängd PER och TIM (på grund av att de bryts ner) startar om klockan igen. Både ljus och temperatur påverkar halten av PER och TIM, och det är så man tänker sig att klockan kan vara känslig för ljus och temperatur som zeitgebers, eftersom en minskning i halten PER och TIM kommer att leda till en fasförsening om det sker på den cirkadianska kvällen, men ett fasavancemang om det sker på den cirkadianska efternatten.[33]
Den biologiska klockan hos ryggradsdjur
På molekylär nivå finns stoira likheter mellan den inre klockan hos lägre djur, som till exempel leddjur, och ryggradsdjur[119]. Vissa klockgener finns dock i olika många kopior hos ryggradsdjur jämfört med insekter[120], och det finns också skillnader i vissa geners specifika funktion i själva klockmekanismen[121]. Samtidigt finns skillnader i hur klockan är anatomiskt organiserad. Sådana skillnader finns också mellan olika grupper av ryggradsdjur. En skillnad mellan till exempel flugor och ryggradsdjur är att klockproteinerna sjäva inte är ljuskänsliga hos ryggradsdjur, troligen eftersom de sistnämnda är större och mer "ogenomskinliga". Själva anatomin för den inre klockan skiljer sig en hel del mellan olika undergrupper av ryggradsdjur. Hos de flesta ryggradsdjur finns det en central "huvudklocka", som beroende på specifik art kan sitta antingen i näthinnan (till exempel hos den afrikanska klogrodan, Xenopus laevis)[122], i tallkottkörteln (som till exempel hos gråsparven, Passer domesticus)[123] eller i den så kallade suprakiasmatiska kärnan i hypothalamus (som till exempel hos däggdjur)[124]. Bland såväl reptiler[125] som fåglar[126] existerar betydande skillnader inom respektive klass, även mellan närbesläktade individer.
Dygnsrytm hos människor
I "grottexperiment" där personer inte kunnat avgöra vilken tid på dygnet det är kan man visa att man på ungefär en månad har förskjutit dygnet med 24 timmar. Detta är särskilt tydligt hos ungdomar. Återgången till normal dygnsaktivitet är vid återinförandet av normala förhållanden snabb.
Om kroppens centralklocka inte justeras genom modulering drar den sig alltså. Vi är beroende av bland annat solen för att kunna hålla en dygnsrytm på 24 timmar.
Det finns människor som har en naturlig dygnsrytm som är avsevärt längre än 24 timmar. Dessa människor har svårt att anpassa sig efter ett dygn på 24 timmar och därför svårt att ha ett "vanligt" jobb.
Modulering av kroppens centralklocka
För att ställa klockan efter den faktiska tiden på dygnet använder sig organismen av särskilda artspecifika så kallade zeitgebers (tyska för tidgivare), som är signaler från omgivningen som indikerar tid på dygnet. Dessa kan exempelvis vara ljus, temperatur och sociala stimuli av olika slag.
Ljus tidigt på morgonen, innan organismen förväntar sig det, tenderar att vrida tillbaka den inre klockan, medan ljus på kvällen, efter att organismen förväntar sig det, tenderar att förskjuta den framåt.
För dygnsmodulering med hjälp av ljus använder vi "ett tredje öga" som utgörs av melanopsininnehållande ganglieceller i retina (näthinnan) som kommunicerar direkt till suprachismaticuscellerna. Dessa utgör 1% av gangliecellerna. Förekomsten av ett tredje öga har bevisats med djurförsök där man iakttagit vid ljusmodulering normal cirkadiansk rytmicitet även vid förlust av övriga tappar och stavar.
En annan viktig komponent vid modulering är våra måltider. SCN-cellerna signalerar rytm såväl elektroniskt som via hormoner. Detta tar sig bland annat uttryck i att aktionspotentialfrekvensen är högre och mer stabil under dagen. Dagtid är också antalet spänningskänsliga kalciumkanaler (av L-typ) dubbelt så hög samt att GABAA-reverseringspotentialen är mer depolariserad. Hormonella faktorer som påverkar rytmen är glukokortikoider, αTGF och prokineteicin 2 (KCC2).
Urverket
Hos friska däggjur är sömnnivåer(REM-sömn vs icke-REM-sömn) och kroppstemperatur harmoniska funktioner av tiden. I försök har man förstört en nervknut kallad nucleus suprachiasmaticus, som sitter strax ovanför (supra) där synnerverna korsar (chiasma) varandra. Detta leder till att kroppstemperatursförändringarna och växlingen mellan REM och icke-REM-sömn blir snabb och oregelbunden. Slutsatsen av experimenten är att kroppens centralklocka är lokaliserad till denna nervknut.
Den molekylära klockan baseras på en fördröjd negativ återkoppling, där klockproteiner spelar en stor roll. Återkopplingen fungerar så att celler avläser (transkripterar)en gen och och producerar ett protein enligt instruktionen. Proteinmolekylerna går ihop två och två och bildar en transkriptionsfaktor. Denna struktur passar ihop med en annan gen och talar om att cellen skall producera proteinet genen instruerar för. De färdiga proteinmolekylerna går ihop två och två och bildar en annan transkriptionsfaktor som binder till den förstnämnda genen och får den att avläsas. Så börjar processen om på nytt.
Dessa transkriptionsfaktorer påverkar även avläsningen av andra gener. Uppemot 10% av människans gener uttrycks olika beroende på dem. Antalet tidsstyrda transkriptionsfaktorer utgör dock ett fåtal.
Forskningshistoria
Den äldsta kända vetenskapliga beskrivningen av en cirkadiansk process är från 300-talet f.Kr. Där berättar den grekiske geografen Androsthenes hur vissa växter öppnar och stänger sina blad beroende på vilken tid på dygnet det är.[127] De första mer systematiska studierna av dygnsrytmen gjordes 1729 av den franske biologen och astronomen Jean-Jacques d'Ortous de Mairan, som studerade bladöppningar och stängningar hos växter i konstant mörker.[108] Under en lång tid rådde oenighet om huruvida dygnsrytmer verkligen alstrades av organismerna själva, eller om dessa kände av någon omgivningsfaktor som man dittills inte kontrollerat i experiment, till exempel förändringar i jordens magnetfält när den roterar runt sin axel.[128] Man har dock i senare studier kunnat visa att den inre klockans egenskaper går att påverka på en mängd olika sätt som inte överensstämmer med hur det borde vara om endast externa faktorer bidrog till organismers dygnsrytm. År 1972 lyckades man lokalisera den inre klockan hos däggdjur till en anatomisk struktur i hjärnan, den så kallade suprakiasmatiska kärnan. På senare tid har framför allt molekylärgenetiska metoder gjort att man fått en större förståelse av de gener som kodar för olika delar av de komplexa system som reglerar dygnsrytmen hos olika organismer.
Referenser
- ↑ Williams SB (2007): A circadian timing mechanism in the cyanobacteria; Adv Microb Physiol 52:229-96
- ↑ Lombardi LM, Brody S (2005): Circadian rhythms in Neurospora crassa: clock gene homologues in fungi; Fungal Genet Biol 42(11):887-92
- ↑ Barak S, Tobin EM, Andronis C, Sugano S, Green RM (2000): All in good time: the Arabidopsis circadian clock; Trends Plant Sci 5, 517–522
- ↑ 4,0 4,1 4,2 Cermakian N, Sassone-Corsi P (2002): Environmental stimulus perception and control of circadian clocks; Curr Opin Neurobiol 12(4):359-365
- ↑ Rensing L, Luoff P (2002): Temperature effect on entrainment, phase shifting, and amplitude of circadian clocks and its molecular bases; Chronobiol Int 19(5):807-864
- ↑ 6,0 6,1 6,2 Paranjpe DA, Sharma VK (2005): Evolution of temporal order in living organisms; J Circ Rhythms 3(1):7
- ↑ 7,0 7,1 Mistlberger RE, Rusak B (2005): Circadian Rhythms in Mammals: Formal Properties and Environmental Influences; i Kryger, Roth, Dement (red): Principles and Practise of Sleep Medicine, 4th ed, Saunders, Philadelphia 2005, sid 321-334
- ↑ Duffy JF, Czeisler CA (2002): Age-related change in the relationship between circadian period, circadian phase, and diurnal preference in humans; Neurosci Lett 318(3):117-120
- ↑ Pittendrigh C, Daan S (1974): Circadian oscillations in rodents: A systematic increase in their frequency with age; Science 186:548-550
- ↑ Valentinuzzi VS, Scarbrough K, Takahashi JS, Turek FW (1997): Effects of aging on the circadian rhythm of wheel-running activity in C57BL/6 mice; Am J Physiol 273:R1957-R1964
- ↑ Page TL, Mans C, Griffeth G (2001): History dependence of circadian pacemaker period in the cockroach; J Insect Physiol 47(9):1085-1093
- ↑ Effects of light on circadian pacemaker development. I. The freerunning period; J Comp Physiol [A] 165(1):41-49
- ↑ 13,0 13,1 Boivin DB, Duffy JF, Kronauer RE, Czeisler CA (1996): Dose-response relationships for resetting of human circadian clock by light; Nature 379(6565):540-542
- ↑ Hut RA, van Oort BE, Daan S (1999): Natural entrainment without dawn and dusk: The case of the European ground squirrel (Spermophilus citellus); J Biol Rhythms 14:290-299
- ↑ Johnson CH (1999): Forty years of PRCs: What have we learned? Chronobiology Int 16(6):711-743
- ↑ Czeisler CA, Kronauer RE, Allan JS, Duffy JF, Jewett ME, Brown EN & Ronda JM (1989). Bright light induction of strong (type 0) resetting of the human circadian pacemaker; Science 244, 1328-1333
- ↑ 17,0 17,1 Koilraj AJ, Sharma VK, Marimuthu G, Chandrashekaran MK: Presence of circadian rhythms in the locomotor activity of a cave dwelling millipede Glyphiulus cavernicolus sulu (Cambalidae, Spirostreptida); Chronobiol Int 17:757-765
- ↑ Quail PH (1991) Phytochrome: a light-activated molecular switch that regulates plant gene expression. Ann Rev Gen 25:389–409
- ↑ 19,0 19,1 Devlin PF (2002): Signs of the time: environmental input to the circadian clock; J Exp Bot 53(374):1535-1550
- ↑ Devlin PF, Kay SA (2000): Cryptochromes are required for phytochrome signaling to the circadian clock but not for rhythmicity; The Plant Cell 12:2499-2510
- ↑ Harmer SL, Hogenesch JB, Straume M, Chang HS, Han B, Zhu T, Wang X, Kreps JA, Kay SA (2000): Orchestrated transcription of key pathways in Arabidopsis by the circadian clock; Science 290:2110–2113
- ↑ Giebultowicz M, Stanewsky R, Hall JC, Hege DM (2000): Transplanted Drosophila excretory tubules maintain circadian clock cycling out of phase with the host; Curr Biol 10:107–110
- ↑ Plautz JD, Kaneko M, Hall JC, Kay SA (1997): Independent photoreceptive circadian clocks throughout Drosophila. Science 278:1632–1635
- ↑ Cermakian N, Pando MP, Thompson CL, Pinchak AB, Selby CP, Gutierrez L, Wells DE, Cahill DM, Sancar A, Sassone-Corsi P (2002): Light Induction of a vertebrate clock gene involves signaling through blue-light receptors and MAP kinases; Curr Biol 12:844–848
- ↑ Provencio I,Rodriguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (2000): A novel human opsin in the inner retina. J Neurosci 20:600–605
- ↑ Sancar A (2000): Cryptochrome: the second photoactive pigment in the eye and its role in circadian photoreception; Ann Rev Biochem 69:31-67
- ↑ Selby CP, Thompson C, Schmitz TM, Van Gelder RN, Sancar A(2000): Functional redundancy of cryptochromes and classical photoreceptors for nonvisual ocular photoreception in mice; Proc Natl Acad Sci USA 97:14697–14702
- ↑ Ruby NF, Brennan TJ, Xie X, Cao V, Franken P, Heller HC, O'Hara BF (2002): Role of melanopsin in circadian responses to light; Science 298(5601):2211-2213
- ↑ Brainard CG, Hanifin JP, Greeson JM, Byrne B, Glickman G, Gerner E, Rollag MD (2001): Action spectrum for melatonin regulation in humans: evidence for a novel circadian photoreceptor. J Neurosci 21:6405–6412
- ↑ Hattar S, Liao HW, Takao M, Berson DM, Yau KW (2002): Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity. Science 295:1065–1070
- ↑ Belenky MA, Smeraski CA, Provencio I, Sollars PJ, Pickard G E (2003): Melanopsin retinal ganglion cells receive bipolar and amacrine cell synapses; J Comp Neurol 460(3):380-393
- ↑ 32,0 32,1 32,2 32,3 32,4 32,5 32,6 32,7 Rensing L, Ruoff P (2002): Temperature effects on entrainment, phase shifting, and amplitude of circadian clocks and its molecular bases; Chronobiol Int 19(5):807-864
- ↑ 33,0 33,1 Sidote D,J Majercak, Parikh V, Edery1 I (1998): Differential Effects of Light and Heat on the Drosophila Circadian Clock Proteins PER and TIM; Mol Cell Biol 18(4):2004-2013
- ↑ Wilkins MB (1983): The Circadian Rhythm of Carbon-dioxide Metabolism in Bryophyllum: The Mechanism of Phase Shift Induction by Thermal Stimuli; Planta 157:471-480
- ↑ Liu Y, Merrow M, Loros JJ, Dunlap JC (1998): How temperature changes reset a circadian oscillator; Science 281(5378):825-829
- ↑ Lakin-Thomas PL (2006): Circadian clock genes frequency and white collar-1 are not essential for entrainment to temperature cycles in Neurospora crassa; Proc Natl Acad Sci U S A 103(12):4469-4474
- ↑ 37,0 37,1 Samach A, Wigge PA (2005): Ambient temperature perception in plants; Curr Opin Plant Biol 8(5):483-486
- ↑ Salomé PA, McClung CR (2005): PSEUDO-RESPONSE REGULATOR 7 and 9 are partially redundant genes essential for the temperature responsiveness of the Arabidopsis circadian clock; Plant Cell 17(3):791-803
- ↑ Farré EM, Harmer SL, Harmon FG, Yanovsky MJ, Kay SA (2005): Overlapping and Distinct Roles of PRR7 and PRR9 in the Arabidopsis Circadian Clock; Curr Biol 15(1):47-54
- ↑ Monroy AF, Dhindsa RS(1995): Low-Temperature Signal Transduction: Induction of Cold Acclimation-Specific Genes of Alfalfa by Calcium at 25°C; Plant Cell 7:321-331
- ↑ Vidal AM, Ben-Cheikh W, Talon M, Garcia-Martinez JL (2003): Regulation of gibberellin 20-oxidase gene expression and gibberellin content in citrus by temperature and citrus exocortis viroid; Planta 217:442–448
- ↑ Saunders DS (red): Insect clocks, Pergamon Press, Oxford, 1982
- ↑ Brown Jr FA, Webb HM (1948): Temperature Relations of an Endogenous Daily Rhythmicity in the Fiddler Crab, Uca; Physiol Zool 21:371-381
- ↑ 44,0 44,1 Lankinen P, Riihimaa A (1997): Effects of Temperature on Weak Circadian Eclosion Rhythmicity in Chymomyza Costata(Diptera:Drosophilidae); J Insect Physiol 43(3):251-260
- ↑ Firth BT, Belan I, Kennaway DJ, Moyer RW (1999): Thermocyclic entrainment of lizard blood plasma melatonin rhythms in constant and cyclic photic environments; Am J Physiol: Regul Integr Comp Physiol 277(6):R1620-R1626
- ↑ Lindberg G, Hayden P (1974): Thermoperiodic entrainment of arousal from torpor in the little pocket mouse, Perognathus longimembris; Chronobiologia 1(4):356-361
- ↑ Ruby NF, Burns DE, Heller HC (1999): Circadian Rhythms in the Suprachiasmatic Nucleus are Temperature-Compensated and Phase-Shifted by Heat Pulses In Vitro; J Neurosci 19(19):8630-8636
- ↑ 48,0 48,1 48,2 48,3 48,4 Mistlberger RE, Skene DJ (2004): Social influences on mammalian circadian rhythms: animal and human studies; Biol Rev 79(3):533-556
- ↑ Viswanathan N, Weaver DR, Reppert SM, Davis FC (1994): Entrainment of the fetal hamster circadian pacemaker by prenatal injections of the dopamine agonist SKF38393; J Neurosci 14:5393-5398
- ↑ Davis FC, Mansion J (1988): Entrainment of hamster pup circadian rhythms by prenatal melatonin injection in hamsters; Am J Physiol 255(3:2):R439-448
- ↑ Reppert SM (1995): Interaction between the circadian clocks of mother and foetus; Ciba Found Symp 183:198-207
- ↑ Weaver DR, Reppert SM (1995): Definition of the developmental transition from dopaminergic to photic regulation of c-fos gene expression in the rat suprachiasmatic nucleus; Brain Res Mol Brain Res 33(1):136-148
- ↑ Mrosovsky N (1988): Phase response curves for social entrainment; J Comp Physiol 162:35-46
- ↑ Antle MC, Mistlberger RE (2000): Circadian clock resetting by sleep deprivation without exercise in the Syrian hamster; J Neurosci 20(24):9326-9332
- ↑ Goel N, Lee TM (1997): Olfactory bulbectomy impedes social but not photic reentrainment of circadian rhythms in female Octodon degus; J Biol Rhythms 12:362-370
- ↑ Amir S, Cain S, Sullivan J, Robinson B, Stewart J (1999): Olfactory stimulation enhances light-induced phase shifts in free-running activity rhythms and Fos expression in the suprachiasmatic nucleus; Neuroscience 92(4):1165-1170
- ↑ Levine JD, Funes P, Dowse HB, Hall JC (2002): Resetting the Circadian Clock by Social Experience in Drosophila melanogaster; Science 298(5600):2010-2012
- ↑ Mrosovsky N(1996): Locomotor activity and non-photic influences on circadian clocks. Biol Rev 71:343-372
- ↑ Mistlberger RE, Skene D (2005): Non-photic entrainment in humans? J Biol Rhythms 20(4):339-352
- ↑ Richter CP (1922): A behavioristic study of the activity of the rat; Comp Physiol Monogr 1:1-54
- ↑ 61,0 61,1 Stephan FK (2002): The "other" circadian system: food as a zeitgeber; J Biol Rhythms 17(4):284-292
- ↑ Mendoza J (2007): Circadian clocks: setting time by food; J Neuroendocrinol 19(2):127-137
- ↑ 63,0 63,1 Wakamatsu H, Yoishinobu Y, Aida R, Moriy T, Akiyama M, Shibata S (2001): Restricted-feeding-induced anticipatory activity rhythm in associated with a phase-shift of the expression in mPer1 and mPer2 mRNA in the cerebral cortex and hippocampus but not in the suprachiasmatic nucleus of mice; Eur J Neurosci 13:1190–1196
- ↑ Stokkan KA, Yamazaki S, Tei H, Sakaki Y, Menaker M (2001): Entrainment of the circadian clock in the liver by feeding; Science 291:490–493
- ↑ Hara R, Wan K, Wakamatsu H, Aida R, Moriya T, Akiyama M, Shibata S (2001): Restricted feeding entrains liver clock without participation of the suprachiasmatic nucleus; Genes Cells 6:269–278
- ↑ Escobar C, Mendoza JY, Salazar-Juarez A, Avila J, Hernandez-Munoz R, Diaz-Munoz M, Aguilar-Roblero R (2002): Rats made cirrhotic by chronic CCl4 treatment still exhibit anticipatory activity to a restricted feeding schedule; Chronobiol Int 19:1073–1086
- ↑ Feillet CA, Albrecht U, Challet E (2006): “Feeding time” for the brain: A matter of clocks; J Physiol (Paris) 100(5-6):252-260
- ↑ Pitts S, Perone E, Silver R (2003): Food-entrained circadian rhythms are sustained in arrhythmic Clk/Clk mutant mice; Am J Physiol Regul Integr Comp Physiol285(1):R57-67
- ↑ 69,0 69,1 Gehring M, Rosbash M (2003): The Coevolution of Blue-Light Photoreception and Circadian Rhythms; J Mol Evol 57:S286–S289
- ↑ Schopf JW, Hayes JM, Walter MR (1983) Earth’s Earliest Biosphere: Evolution of the earth’s earliest ecosystems: Recent progress and unsolved problems. Princeton University Press, Princeton, NJ, sidorna 361–384
- ↑ Storz UC, Paul RJ (1998) Phototaxis in water fleas (Daphnia magna) is differently influenced by visible and UV light. J Comp Physiol A 183:709–717
- ↑ DeCoursey PJ, Krulas JR, Mele G, Holley DC (1997): Circadian performance of suprachiasmatic nuclei (SCN)-lesioned antelope ground squirrels in a desert enclosure. Physiol Behav 62:1099-1108
- ↑ DeCoursey PJ, Walker JK, Smith SA (2000): A circadian pacemaker in free-living chipmunks: essential for survival? J Comp Physiol A 186:169-180
- ↑ McCluskey ES (1992): Periodicity and diversity in ant mating flights; Comp Biochem Physiol A 103(2):241-243
- ↑ Trajano E, Manno-Baretto L: Free running locomotor activity rhythms in cave dwelling catfishes Trichomycterus sp. from Brazil. Biol Rhythms Res 27:329-335
- ↑ 76,0 76,1 Ouyang Y, Andersson CR, Kondo T, Golden SS, Johnson CH (1998): Resonating Circadian Clocks enhance fitness in cyanobacteria; Proc Natl Acad Sci U S A95:8660-8664
- ↑ Klarsfeld A, Rouyer F (1998): Effect of circadian mutations and LD periodicity on the life span of Drosophila melanogaster. J Biol Rhythms 13:471-478
- ↑ 78,0 78,1 Sharma VK (2003): Adaptive significance of circadian clocks; Chronobiol Int 20(6):901-919
- ↑ Emerson KJ, Bradshaw WE, Holzapfel CM (2008): Concordance of the circadian clock with the environment is necessary to maximize fitness in natural populations; Evolution 62(4):979-983
- ↑ Young MW, Kay SA (2001): Time zones: a comparative genetics of circadian clocks; Nat Rev Genetics 2:702-715
- ↑ Rand DA, Shulgin BV, Salazar JD, Millar AJ (2006): Uncovering the design principles of circadian clocks: Mathematical analysis of flexibility and evolutionary goals; J Theor Biol 238(3):616-635
- ↑ 82,0 82,1 Dvornyk V, Vinogradova O, Nevo E (2003): Origin and evolution of circadian clock genes in prokaryotes; Proc Natl Acad Sci U S A 100(5):2495-2500
- ↑ Wells JW(1963): Coral growth and geochronometry; Nature 197:948-950
- ↑ Shadan FF (2007): Circadian tempo: A paradigm for genome stability; Med Hypotheses 68(4):883-891
- ↑ Johnson CH, Golden SS, Kondo T (1998): Adaptive significance of circadian programs in cyanobacteria; Trends Microbiol 6(10):407-410
- ↑ Maheshwari R (2007): Circadian rhythm in the pink-orange bread mould Neurospora crassa: For what? J Biosci 32(6):1053-1059
- ↑ Rosato E, Tauber E, Kyriacou CP (2006): Molecular genetics of the fruit fly circadian clock; Eur J Hum Genet 14(6):729-738
- ↑ Yuan Q, Metterville D, Briscoe AD, Reppert SM (2007): Insect cryptochromes: gene duplication and loss define diverse ways to construct insect circadian clocks; Mol Biol Evol 24(4):948-955
- ↑ Lin GG, Liou RF, Lee HJ(2002): The period gene of the German cockroach and its novel linking power between vertebrate and invertebrate; Chronobiol Int 19(6):1023-1040
- ↑ 90,0 90,1 Klein DC(2006): Rvolution of the vertebrate pineal gland: The AANAT hypothesis; Chronobiol Int 23(1-2):5-20
- ↑ 91,0 91,1 Klein DC(2004): The 2004 Aschoff/Pittendrigh Lecture: Theory of the Origin of the Pineal Gland — A Tale of Conflict and Resolution; J Biol Rhythms 19(4):264-279
- ↑ Pittendrigh CS(1993): Temporal organization: Reflections of a Darwinian watchmaker; Annu Rev Physiol 55:17-54
- ↑ Woelfle MA, Ouyang Y, Phanvijhitsiri K, Johnson CH(2004): The adaptive value of circadian clocks: An experimental assessment in cyanobacteria; Curr Biol 14:1481–1486
- ↑ Grobbelaar N, Huang TC, Lin HY, Chow TJ(1986): Dinitrogen-fixing endogenous rhythm in Synechococcus RF-1; FEMS Microbiol Lett 37:173–177
- ↑ Mori T, Binder B, Johnson CH(1996): Circadian gating of cell division in cyanobacteria growing with average doubling times of less than 24 hours; Proc Natl Acad Sci U S A 93:10183–10188
- ↑ Smith RM, Williams SB(2006): Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus; Proc Natl Acad Sci U S A 103:8564–8569
- ↑ Johnson CH, Mori T, Xu Y(2008): A cyanobacterial circadian clockwork; Curr Biol 18(17):R816-825
- ↑ Nakajima M, Imai K, Ito H, Nishiwaki T, Murayama Y, Iwasaki H, Oyama T, Kondo T (2005): Reconstitution of circadian oscillation of cyanobacterial KaiC phosphorylation in vitro; Science 308:414–415
- ↑ Kitayama Y, Nishiwaki T, Terauchi K, Kondo T (2008): Dual KaiC-based oscillations constitute the circadian system of cyanobacteria; Genes Dev 22(11):1513–1521
- ↑ Vitalini MW, de Paula RM, Park WD, Bell-Pedersen D (2006): The rhythms of life: circadian output pathways in Neurospora; J Biol Rhythms 21(6):432-444
- ↑ Feldman JF, Hoyle MN (1973): Isolation of circadian clock mutants of Neurospora crassa; Genetics 75:605-613
- ↑ Brunner M, Kàldi K (2008): Interlocked feedback loops of the circadian clock of Neurospora crassa; Mol Microbiol 68(2):255-262
- ↑ He Q, Cheng P, Yang Y, He Q, Yu H, Liu Y (2003): FWD1-mediated degradation of FREQUENCY in Neurospora establishes a conserved mechanism for circadian clock regulation; EMBO J 22(17):4421-4430
- ↑ Liu Y, Bell-Pedersen D (2006): Circadian Rhythms in Neurospora crassa and Other Filamentous Fungi; Eukaryot Cell 5(8):1184-1193
- ↑ Dodd AN, Salathia N, Hall A, Kévei E, Tóth R, Nagy F, Hibberd JM, Millar AJ, Webb AA (2005): Plant circadian clocks increase photosynthesis, growth, survival, and competitive advantage; Science 309(5734):630-633
- ↑ Green RM, Tingay S, Wang ZY, Tobin EM (2002): Circadian rhythms confer a higher level of fitness to Arabidopsis plants; Plant Physiol 129(2):576-584
- ↑ Michael TP, Salomé PA, Yu HJ, Spencer TR, Sharp EL, McPeek MA, Alonso JM, Ecker JR, McClung CR (2004): Enhanced fitness conferred by naturally occurring variation in the circadian clock; Science 302(5647):1049-1053
- ↑ 108,0 108,1 Gardner MJ, Hubbard KE, Hotta CT, Dodd AN, Webb AA (2006): How plants tell the time; Biochem J 397(1):15-24
- ↑ 109,0 109,1 Helfrich-Förster C, Stengl M, Homberg U (1998): Organization of the circadian system in insects; Chronobiol Int 15(6):567-594
- ↑ Konopka RJ, Benzer S (1971): Clock mutants of Drosophila melanogaster; Proc Natl Acad Sci U S A 68:2112–2116
- ↑ Reppert SM (2007): The ancestral circadian clock of monarch butterflies: role in time-compensated sun compass orientation; Cold Spring Harb Symp Quant Biol 72:113-118
- ↑ Howlader G, Sharma VK (2006): Circadian regulation of egg-laying behavior in fruit flies Drosophila melanogaster; J Insect Physiol 52(8):779-785
- ↑ DeCoursey PJ: Functional Organization of Circadian Systems in Multicellular Animals; i Dunlap JC, Loros JJ, DeCoursey PJ (red): Chronobiology: Biological Timekeeping, Sinauer, Massachusetts 2004, sid 145-181
- ↑ Tomioka K, Abdelsalam S (2004): Circadian organization in hemimetabolous insects; Zoolog Sci 21(12):1153-1162
- ↑ Renn SCP, Park JH, Rosbash M, Hall JC, Taghert PH (1999) A pdf neuropeptide gene mutation and ablation of PDF neurons each cause severe abnormalities of behavioral circadian rhythms in Drosophila; Cell 99:791–802
- ↑ Boothroyd CE, Young MW (2008): The in(put)s and out(put)s of the Drosophila circadian clock; Ann N Y Acad Sci 1129(1):350-357
- ↑ Price JL, Blau J, Rothenfluh A, Abodeely M, Kloss B, Young MW: Double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation; Cell 10;94(1):83-95
- ↑ Collins B, Blau J (2007): Even a stopped clock tells the right time twice a day: circadian timekeeping in Drosophila; Pflügers Archiv 454(5):857-867
- ↑ Vallone D, Lahiri K, Dickmeis T, Foulkes NS (2007): Start the clock! Circadian rhythms and development; Dev Dyn 236(1):142-155
- ↑ Tauber E, Last KS, Olive PJW, Kyriacou CP (2004): Clock gene evolution and functional divergence; J Biol Rhtythms 19(5):445-458
- ↑ Wager-Smith K, Kay SA (2000): Circadian rhythm genetics: from flies to mice to humans; Nature Genetics 26(1):23-27
- ↑ Cahill GM, Besharse JC (1993): Circadian clock functions localized in Xenopus retinal photoreceptors; Neuron 10(4):573-577
- ↑ Zimmerman NH, Menaker M (1979): The pineal gland: a pacemaker within the circadian system of the house sparrow. Proc Natl Acad Sci U S A 76:999–1003
- ↑ Ralph MR, Foster RG, Davis FC, Menaker M (1990): Transplanted suprachiasmatic nucleus determines circadian period; Science 247(4945):975-982
- ↑ DeCoursey PJ: Functional organization of circadian systems in multicellular animals; i Dunlap JC, Loros JL, DeCoursey PJ (red): Chronobiology: Biological Timekeeping, Sinauser, Massachussetts 2004
- ↑ Underwood H, Steelse CS, Zivkovic B (2001): Circadian Organization and the Role of the Pineal in Birds; Microsc Res Tech 53:48-62
- ↑ Moore-Ede CM, Sulzman FM, Fuller CA (1982): The Clocks That Time Us; Cambridge, MA: Harvard University Press
- ↑ Brown FA (1960): Response to pervasive geophysical factors and the biological clock problem; Cold Spring Harb Symp Quant Biol 25:57-72






.jpg/300px-Drosophila_melanogaster_-_side_(aka).jpg)
.jpg/300px-Sea-hare-morro-bay_(431920585).jpg)
