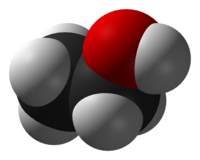
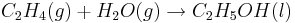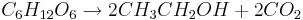Etanol
Från Rilpedia
- Se E85 (bränsle) för etanol som fordonsbränsle.
| Allmänt | |
|---|---|
| Namn | Etanol (sprit) |
| Kemisk formel | C2H5OH |
| Molekylmassa | 46,069 u |
| CAS-nummer | 64-17-5 |
| UN-nummer | 1170 |
| Fasbeteende | |
| Smältpunkt | 158,8 K (–114,3 °C, –173,83 °F) |
| Kokpunkt | 351,5 K (78,4 °C, 173,03 °F) |
| Trippelpunkt | 159 K (–114 °C, –173,47 °F) |
| Kritisk punkt | 514 K (241 °C, 465,53 °F), 63 bar |
| ΔfusH | 4,9 kJ/mol |
| ΔfusS | 31 J/mol·K |
| ΔvapH | 38,56 kJ/mol |
| Löslighet | Lösligt i vatten |
| Syra–bas-egenskaper | |
| pKa | 15,9 (H+ från OH-grupp) |
| pH | 7,0 (neutral) |
| Vätskeegenskaper | |
| ΔfH0liquid | –277,38 kJ/mol |
| S0liquid | 159,9 J/mol·K |
| Cp | 112,4 J/mol·K |
| Densitet | 789 gram/l |
| Gasegenskaper | |
| ΔfH0gas | –235,3 kJ/mol |
| S0gas | 283 J/mol·K |
| Cp | 65,21 J/mol·K |
| Säkerhetsaspekter | |
| Akuta effekter | Illamående, kräkningar, CNS-depression. Död vid allvarliga fall. |
| Kroniska effekter | Beroende, levercirros. |
| Flampunkt | 17 °C (62,6 °F) |
| Självantändningstemperatur | 425 °C (797 °F) |
| Explosiv gräns | 3,5–15 % |
Etanol, även kallat etylalkohol, kemisk formel C2H5OH, är en alkohol, som genom att den har så kort kolkedja har en för alkoholer jämförelsevis hög vattenlöslighet. Alla alkoholer har en viss giftverkan, men etanol är den minst giftiga av de envärda alkoholerna, och kan i utspädd form och i tillräckligt små doser förtäras utan allvarliga men. Etanol utgör den rusframkallande komponenten i drycker som öl, vin och sprit.
Framställning sker oftast genom jäsning av sockerhaltiga vätskor från kolhydratrika jordbruksprodukter såsom sockerrör, majs och spannmål. Viss teknisk sprit för industriellt bruk kan vara gjord av petroleum. Bioetanol kallas av några tillverkare den etanol som är framställd av biomassa.
Etanol bör inte förväxlas med metanol (träsprit) som i små doser leder till blindhet med mera, och i högre doser till döden.
Etanol omvandlas i kroppen av enzymet alkoholdehydrogenas, först till acetaldehyd och sedan till ättiksyra. Den specifika energin (energivärdet) för etanol är 30 kJ/g (7 kcal/g) vilket kan jämföras med kolhydraternas och proteinernas 17 kJ/g (4,1 kcal/g) och fettets 38 kJ/g (9 kcal/g).
Etanol används även som motorbränsle, se E85 (bränsle).
Innehåll |
Historia
Etanol har använts som konserveringsmedel och ingrediens i drycker sedan lång tid tillbaka och används även idag inom en mängd olika områden, som exempelvis industri, medicin, forskning och i många olika drycker.
Det var troligen persiska alkemister, som Geber (721-815) och Al-Razi (864-930), som utvecklade destilleringen och lyckades få fram relativt ren etanol.
I Gamla testamentet finns många varningar för missbruk av vin. Antika Greklands och Roms lagstiftare belade dryckenskap med straff. Seneca d.y. beskriver alkoholismens viktigaste symptom.
Konsten att bereda sprit (det vill säga mer koncentrerad etanol) uppfanns dock långt senare, under medeltiden. Etanol fick med tiden högt anseende som läkemedel, vilket bland annat framgår av benämningen aqva vitae (livsvatten). På 1500-talet hade etanol redan blivit ett välkänt dietiskt medel som prisades som skyddsmedel mot alla möjliga sjukdomar.
Missbrukets följder började nu också att oftare visa sig, och alkoholismen i sina olika former började bli en allmänt förekommande sjukdom. Namnet alkoholism är emellertid av mycket yngre datum. Det infördes först av Magnus Huss, vars avhandling Alcoholismus chronicus 1851 för första gången gav en vetenskaplig utredning av alkoholförgiftningens verkningar. I början av 1900-talet var missbruket av spritdrycker, och i sammanhang därmed alkoholismen, spritt över hela världen.
Se även Sveriges alkoholhistoria.
Giftverkan hos alkohol samt alkoholkonsumtionens risker
- Huvudartikel: Alkoholdryck
Etanol är ett farligt gift. Det kan orsaka död och/eller kräkningar vid för höga doser och leverskador (skrumplever) och hjärnskador vid regelbundet nyttjande. Några andra vanliga skador av alkoholmissbruk är depression, dystymi, impotens, cancer i oesophagus (matstrupen) och malnutrition. Ett kraftigt alkoholrus kan ge upphov till minnesförlust, "black out" med huvudvärk efter tillnyktringen. Etanol är dock inte lika farligt som andra alkoholer, exempelvis metanol, som ofta är dödliga eller mycket skadliga även i små doser. Långvarigt alkoholmissbruk kan ge upphov till hallucinationer "farliga skära elefanter i rummets alla hörn", delirium tremens, därav det vardagliga uttrycket dille. Biokemiskt är det den reaktiva etanolmetaboliten acetaldehyd som troligen är orsaken till skadorna.
Alkoholkonsumtion ökar risken för cancer i munnen, esofagus, pharynx, larynx och levern hos män och kvinnor, och för bröstcancer hos kvinnor. I allmänhet så ökar dessa risker efter ungefär ett glas om dagen för kvinnor och två glas om dagen för män. Risken för levercancer ökar markant om man dricker fem eller fler glas om dagen. Ett stort intag av alkohol ökar också risken för tarmcancer, samt till högre risk för de flesta alkohol-relaterade cancerformerna [1].
Etanolmolekylen
Etanol har molekylformeln C2H5OH. I vardagligt tal används ordet alkohol vanligen för etanol eller drycker innehållande etanol. I kemiska sammanhang betecknar ordet alkohol däremot en massa olika ämnen, varav metanol och etanol är de enklaste.
Etanol är hydroxiderivatet av etan, eftersom det är detta ämne som erhålls byter en väteatom i etan (C2H6) mot en hydroxylgrupp. Etanol har enbart en OH-grupp, och är därför en envärd alkohol. Det är OH-gruppen som är ämnets funktionella grupp, det vill säga den grupp som avgör vilka egenskaper ämnet kommer att få. Etanol kan även ses som ett derivat av vatten, med en etylgrupp ersättande en av väteatomerna.
Alkoholer kan vara primära, sekundära och tertiära beroende på hur många kolatomer som binder den kolatom, som även binder hydroxylgruppen. Etanol är av naturliga skäl primär, eftersom dess molekyler innehåller endast två kolatomer.
Egenskaper
Etanol är en brandfarlig, färglös, kemisk förening. Etanol är, precis som alla andra alkoholer, mer löslig i vatten än motsvarande kolväte. Anledningen till detta är att etanolen är polär, precis som vatten. Eftersom både vatten och etanol innehåller OH-grupper kan det uppstå starka vätebindningar mellan deras hydroxylgrupper.
Etanol förekommer oftast inte i högre koncentrationer än 96 %. Destillation till högre koncentration omöjliggörs av att etanol vid denna koncentration bildar en azeotrop med vatten, det vill säga ångan som bildas består av 96 % etanol och 4 % vatten. För att framställa högre koncentrationer måste man ta bort vattnet på andra sätt, antingen genom torkmedel eller genom att tillsätta ett annat ämne som bildar en azeotrop med vatten vid lägre temperatur än etanol. När man destillerar av det tillsatta ämnet följer vattnet med. Eftersom etanol är hygroskopiskt måste vattenfri etanol förvaras lufttätt för att inte åter suga upp vatten från luften. Det krävs även speciella metoder för att föra över den vattenfria etanolen från lagringskärlet till reaktionskärlet utan att det ska ta upp vatten.
Enligt lika löser lika-regeln så är etanol ett bra lösningsmedel för andra polära ämnen (det kan till och med lösa vissa oorganiska salter). Men etanol kan även lösa ämnen som är "olösliga" i vatten. Det beror på att etanols kolkedja kan binda till andra organiska molekylers kolkedjor. Eftersom kolkedjedelen i etanol är opolär kan det alltså lösa opolära ämnen, som exempelvis kolväten.
I etanol uppmuntrar OH-gruppen till löslighet i vatten, och kolkedjan motsätter sig det. Men eftersom kolkedjan är så pass kort så får ändå hydroxylgruppen övertaget. Detta är dock inte fallet med envärda alkoholer med 5 eller fler kolatomer i kedjan.
På grund av vätebindningarna har etanol en mycket högre kokpunkt än etan (i etan är ju vätebindningar ej möjliga). Etan är gas vid rumstemperatur, medan etanol är vätska. Etanols smältpunkt är –144 °C och dess kokpunkt 78 °C.
Dess pKa-värde är 15,9. Det är ett neutralt ämne, och har alltså ett pH på 7,0. Densiteten är 789 gram per liter. Brytningsindex vid rumstemperatur är 1,36.
Framställning
Etanol framställs främst genom två processer, hydrering av eten och fermentering av socker. Hydrering av eten är den primära framställningsmetoden av etanol inom industrin, medan fermentering huvudsakligen används för framställning av alkoholhaltiga drycker.
Industriell produktion
Industriell etanol produceras främst genom syrakatalyserad hydrering av eten. Anledningen till detta är att eten är relativt billig att införskaffa. Reaktionen ser (förenklat) ut så här:
För att minska behovet av strikt kontroll och höga skatter på industriellt producerad etanol görs den odrickbar (denatureras) genom tillsats av olika ämnen. Det finns en mängd olika sådana ämnen, och vilket som används beror på vad etanolen skall användas till. Ämnet ifråga kan ge en obehaglig smak, annorlunda färg eller till och med göra den livsfarlig att konsumera. Några av de ämnen som används för detta syfte är metanol, terpentin och aceton.
Fermentering
- Huvudartikel: Fermentering
All etanol för drycker och mycket av den etanol som används i industrin produceras genom fermentering av en mängd olika produkter, som exempelvis spannmål, majs, potatis, frukt och socker. Före slutet av 1940-talet framställdes den industriella etanolen huvudsakligen genom fermentering, men som beskrivs ovan är hydrering av eten vanligast idag. Fermentering är en biologisk process där mikroorganismer växer till och konsumerar näringsämnen i sin omgivning. Vid framställning av exempelvis vin, sker detta genom att jästsvamp får växa i en lösning av sockerhaltig fruktsaft. Jästen förbrukar sockret och ger ifrån sig etanol och koldioxid samt en mängd andra ämnen som ger en speciell smak.
Ekvationen för fermentering av glukos (en sockerart) är:
I denna reaktion, som även kallas glykolys, är det alltså jästen som omvandlar glukos till etanol och koldioxid.
Man kan även få etanol genom en omvänd esterreaktion och hydrering (omvänd oxidering) av etanal och etansyra (se vidare under reaktioner).
Användningsområden
| De vanligaste användningsområdena för etanol är lösningsmedel och berusningsmedel. Till vänster 94 %-ig denaturerad etanol för hushållsbruk och till höger öl, som vanligtvis har en etanolhalt på 3,5–5,5 %. Ett växande användningsområde är som fordonsbränsle, se E85. |
Etanol i industrin
Etanol är speciellt användbar inom industrin under namnet teknisk sprit på grund av bra egenskaper som lösningsmedel. Industriellt producerad etanol har många användningsområden, till exempel vattenbaserade färger, läkemedel, parfymer, rengöringsprodukter, lacker och bläck. Denna sprit har gjorts mycket svår att använda som dryck genom att tillverkarna har denaturerat spriten, det vill säga tillsatt ämnen som framkallar kräkning, smakar och luktar mycket illa, till exempel aceton. Se även T-Röd.
Etanol som fordonsbränsle
Etanol kan användas i en förbränningsmotor på samma sätt som bensin. Nästan all bensin som säljs i Sverige innehåller 5 volymprocent etanol. Det utgör ungefär 340 000 mkubikmeter etanol som förbrukas i vanliga bensinfordon.
I mycket mindre skala används också en blandning av etanol och bensin, så kallad E85. Eftersom etanol har ett högre oktantal än bensin (104 ron) och brinner långsammare kan motorn få en högre verkningsgrad än vid bensindrift. Etanol har ett mindre energivärde per liter än bensin.
Avgaserna från etanoldrift kan ger upphov till hälsoproblem, särskilt vid låga temperaturer kan utsläppen av polycykliska aromatiska kolväten (PAH) vara högre än från bensinbilar. Nivåerna av aldehyder var högre för E85 än för bensin vid praktiskt taget alla testade förhållanden.Utsläppen från etanol- och biogasbilar jämförda med bensinbilar
Etanol innehåller inte svavel eller cykliska kolväten, till exempel bensen. Inget sot bildas i en etanolmotor eftersom det vid ofullständig förbränning endast bildas acetaldehyd och en mycket liten mängd formaldehyd. Den allra största andelen (cirka 90 %) av de oförbrända ämnena är dock ren etanol som även finns med i det naturliga kretsloppet och därför i dessa sammanhang är försumbart. Bilar som kan köras på både bensin och etanol (E85) kallas FFV vilket står för Flexi Fuel Vehicle. Det är möjligt att konvertera bensinbilar till att gå på etanol.
Etanol i drycker
Etanol är en drog som förekommer i alkoholhaltiga drycker. Andelen ren etanol i dessa drycker varierar kraftigt: från 2,25 % för cider till 50 % för starksprit.
Övriga användningsområden
Etanol kan även användas inom vården, så kallad läkarsprit.
Etanol används även i antifrysprodukter för dess låga fryspunkt.
Lösningar med 70-85 % etanol används ofta i desinficeringsmedel.
Reaktioner
Etanol oxideras i två steg.
OH-gruppen är inte en bra lämnande grupp för nukleofila substitutionsreaktioner, så neutrala alkoholer reagerar ej i sådana reaktioner. Men om syret först blir protonerat för att skapa C2H5OH2+ är den lämnande gruppen mycket mer stabil och nukleofil substitution kan inträffa. Etanol är själv nukleofil, så C2H5OH2+ kan reagera med C2H5OH för att producera dietyleter ("vanlig eter") och vatten (se nedan).
Etanol och etansyra (ättiksyra) kan, med svavelsyra (H2SO4) som katalysator, bilda en ester:
- Etansyra + Etanol
 Etyletanoat + Vatten
Etyletanoat + Vatten
Estern som bildas kallas etylacetat eller etyletanoat och ingår i salubrin. Detta ämne har en låg kokpunkt, och är betydligt flyktigare än etansyran. Det beror på att estermolekylerna, i motsats till syra- och alkoholmolekylerna, inte har några OH-grupper som kan ge vätebindningar. Den är även mer svårlöslig i vatten än syran den bildades av. Även detta beror på att vätebindningar ej är möjliga. Etylacetat används som lösningsmedel.
När etanol upphettas tillsammans med koncentrerad svavelsyra kan det bildas eten, C2H4. Ett sätt att beskriva detta är att säga att väteatomen och OH-gruppen har eliminerats, därför är det en eliminationsreaktion. Denna reaktion är för övrigt den motsatta mot den som används för att framställa etanol inom industrin (se vidare under framställning).
Om reaktionen sker vid lägre temperaturer (140–150 °C) tas väteatomen och hydroxylgruppen från två olika etanolmolekyler. Detta är en kondensationsreaktion. Vid en kondensationsreaktion kopplas två eller flera molekyler ihop samtidigt som det spjälkas av en eller flera molekyer, ofta vattenmolekyler. Produkten i denna reaktion kallas dietyleter (eller vanlig eter) och är en eter. Den har en mycket lägre kokpunkt än etanol (på grund av att den inte har någon hydroxylgrupp) och är även mindre reaktiv. Den är även svårlöslig i vatten.
Se även
Externa länkar
Referenser
Sjukvårdsupplysningen: Dricka lagom [1]
| Den här artikeln saknar källhänvisningar. Förbättra gärna artikeln genom att lägga till pålitliga källor (helst fotnoter). Material som inte kan verifieras kan ifrågasättas eller tas bort. (april 2009) |
|
|||||||||||||||||