Tuberkulos
Från Rilpedia
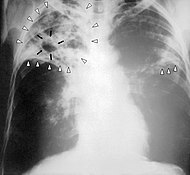
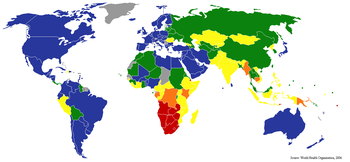
| Röntgenbild av lungorna på en patient som lider av tuberkulos. | ||
| ICD-10 | A15.
-A19. |
|
| ICD-9 | 010-018 | |
| OMIM | 607948 | |
| DiseasesDB | 8515 | |
| MedlinePlus | 000077 000624 | |
| eMedicine | med/2324 emerg/618 | |
| MeSH | C01.252.410.040.552.846 | |
Tuberkulos (tbc/tb) eller lungsot är en infektionssjukdom som vanligtvis orsakas av tuberkelbakterien Mycobacterium tuberculosis.[1] Andra bakterier av samma släkte, som Mycobacterium bovis, Mycobacterium africanum, Mycobacterium canetti, och Mycobacterium microti kan också orsaka tuberkulos, men dessa är mindre vanliga.
Tuberkulos drabbar framförallt lungorna, men kan även sätta sig i många andra organ, t.ex. centrala nervsystemet, fortplantningsorganen, mag-tarmkanalen, blodomloppet, skelettet, leder, eller huden.
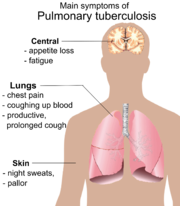
De klassiska symtomen på tuberkulos är kronisk hosta med blodigt slem, feber, nattlig svettning, och viktförlust. Infektion i andra organ kan ge en mångfald olika symtom beroende på vilket organ som är drabbat. Medicinsk diagnos av tuberkulos baseras främst på röntgenbilder av lungorna och tuberkulintest på huden (Mantoux-test). Mikroskopundersökning och bakterieodling av kroppsvätskor kan också användas.
Tuberkulosbehandling är långvarig och omständlig och kräver många månaders intag av flera olika antibiotika. Den sjukes kontakter undersöks också, och behandlas vid behov. Antibiotikaresistens är ett snabbt växande problem som ofta uppstår om en pågående antibiotikabehandling mot sjukdomen blir ofullständig, så att ett eller flera av de ordinerade läkemedel utelämnas eller hela kursen inte fullföljs. Orsaken är ofta en otillförlitlig tillgång på läkemedel. Förebyggande av tuberkulos vilar på screeningprogram och vaccinering, oftast med BCG-vaccin (Bacillus Calmette Guerin).
Tuberkulos sprids genom luften, när människor med sjukdomen hostar, nyser eller spottar. En tredjedel av världens befolkning har infekterats med M. tuberculosis, och infektionstakten uppskattas till en person per sekund i världen[2]. De flesta infekterade kommer dock aldrig att utveckla aktiv tuberkulos. Asymtomatisk latent infektion är det vanligaste. Omkring en på tio av dessa latenta infektioner utvecklas så småningom till aktiv sjukdom som, om den inte behandlas, dödar mer än hälften av sina offer. Enligt statistik från 2004 fanns 14,6 miljoner fall av kronisk aktiv tuberkulos, 8,9 miljoner nya fall, och 1,6 miljoner dödsfall, de flesta i utvecklingsländer.[2] Därutöver drabbas ett växande antal människor av tuberkulos även i i-länder därför att deras immunsystem inte fungerar normalt till följd av immunosuppressiva läkemedel, drogmissbruk, eller AIDS.
Tuberkulosfallen är långt ifrån jämnt utspridda över världen. I många länder i Asien och Afrika har 80% av befolkningen positivt utslag i tuberkulintest, medan bara 5-10% har det i USA[1].
Sjukdomen förekommer också hos djur, och är en zoonos, alltså en sjukdom som är överförbar mellan djur och människor. Bland djur finns också formerna aviär tuberkulos och bovin tuberkulos, vilka alla är zoonoser.
Tuberkelbakterien kan ligga vilande i lungorna i åratal, men aktiveras som ett svar på en immunbristsjukdom (exempelvis AIDS), vid hög ålder eller vid immunologisk stress. Aktivering sker dock oftast utan någon påvisbar anledning, och är vanlig hos unga vuxna. Människans egna immunförsvar kan inte oskadliggöra tuberkelbakterien, utan istället bildar makrofager och lymfocyter inflammatoriska härdar i lungorna som går under namnet granulom.
Innehåll |
Historik
Under 1920-talet infördes vaccination mot tuberkulos med hjälp av BCG-vaccinet. Även idag används BCG i de länder där sjukdomen är endemisk, men nya vaccin är under utveckling eftersom BCG är tämligen ineffektivt mot tbc i andningsvägarna.
Förr var tuberkulos en mycket vanlig och dödlig sjukdom även i västvärlden, där behandling skedde på särskilda sanatorier. Tuberkulos är fortfarande ett stort problem i Afrika och delar av Asien, och problemet förvärras av att sjuka med AIDS lätt drabbas. I Baltikum och Ryssland är sjukdomen också ett stort problem, eftersom motståndskraftiga bakterier där är mycket vanliga. Tuberkulos sprids av att obehandlade sjuka hostar, eller genom annan nära kontakt.
Sverige
Omkring 500 personer insjuknar i tuberkulos varje år i Sverige, vilket är bland de absolut lägsta talen i världen.[3], att jämföra med 20 000 fall om året så sent som på 1940-talet[4] Majoriteten av dessa 500 tuberkulosfall är antingen "importerade" från länder med endemisk tuberkulos, eller inträffar hos människor med nedsatt immunförsvar.[5][6]
Fram till 1975 vaccinerades rutinmässigt alla nyfödda i Sverige med BCG-vaccin. Sedan dess är vaccinationen valfri, och erbjuds alla barn som kan förväntas komma i kontakt med riskgrupper eller riskområden.[7]
Äldre benämningar på tuberkulos i Sverige är tvinsot, lungsot och hektisk feber.[8]
Tuberkulossjukdomen regleras av Smittskyddslagen och epizootilagen.
Symtom
När sjukdomen blir aktiv är 75% av fallen i lungorna. Symtomen inkluderar bröstsmärtor, blodiga upphostningar, och långvarig hosta i mer än tre veckor. Systemiska symtom är feber, frossa, nattliga svettningar, aptitförlust, viktförlust, blekhet, och ofta en kraftlöshet och tendens att lätt bli utmattad.[2]
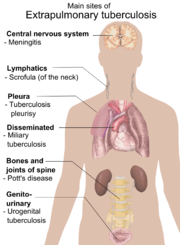
I övriga 25% sätter sig infektionen någon annanstans än i lungorna och orsakar andra former av tuberkulos, som tillsammans kallas extrapulmonär tuberkulos.[9] Detta inträffar oftare hos personer med försvagat immunsystem och små barn. Organ som ofta drabbas är:
- Centrala nervsystemet (meningit)
- Lymfsystemet (hals-skrofler)
- Ben och leder (Potts sjukdom)
- Fortplantningsorganen
En särskilt allvarlig form av tuberkulos är miliar tuberkulos, där sjukdomen är utbredd i kroppen via blodomloppet.
Även om extrapulmonär tuberkulos normalt inte är smittsam, så kan den samexistera med lungtuberkulos som är smittsam.[10]
Bakterier som orsakar tuberkulos
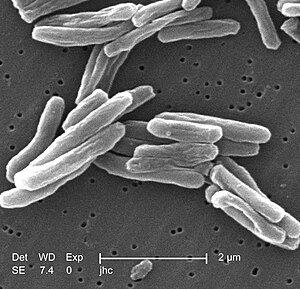
Den primära orsaken till tuberkulos, Mycobacterium tuberculosis (MTB), är en aerob bakterie som delar sig var 16:e till 20:e timme, en mycket långsam delningstakt jämfört med många andra bakterier, som ofta delar sig en gång i timmen eller mer.[11]
Eftersom MTB har en cellvägg men saknar fosfolipider i sitt yttre cellmembran klassas den som grampositiv. Gramfärgning fungerar dock dåligt på MTB, den antingen färgas bara svagt, eller håller inte kvar färgen.[12]
MTB är en liten stavformad bacill som kan motstå svaga desinfektionsmedel och överleva som torra sporer i flera veckor. I naturen kan bakterien bara växa inne i celler, men det går att odla den i laboratorium.[13]
MTB kan identifieras i mikroskop med hjälp av histologisk färgning av upphostat slem. Eftersom MTB behåller vissa färgningar efter syrabehandling klassas den som en syrafast bakterie.[1][12] Den vanligaste syrafasta färgningstekniken, Ziehl-Neelsen, färgar MTB klarröd, så att den tydligt syns mot en blå bakgrund. Andra sätt att visualisera den inkluderar auramin-rhodamin-färgning och fluorescent mikroskopi.
Flera nära släktingar till M. tuberculosis kan också orsaka tuberkulos:
M. africanum är inte särskilt vanlig i världen, men i delar av Afrika står den för en signifikant andel av tuberkulosfallen.[14][15]
M. bovis är som namnet anger främst förknippad med tuberkulossmitta hos nötkreatur, och var tidigare vanlig även hos människor som smittades via bland annat infekterad mjölk. Men pastörisering av mjölk har i stort sett eliminerat den smittkällan, åtminstone i i-länder.[1][16]
M. microti påträffas mest hos människor med försvagat immunsystem, även om det är möjligt att dess förekomst har underskattats.[17]
Andra kända sjukdomsalstrande mykobakterier inkluderar Mycobacterium leprae, Mycobacterium avium och Mycobacterium kansasii. Som namnet anger så är M. leprae huvudorsaken till spetälska (lepra). De andra två orsakar varken tuberkulos eller spetälska, men de kan orsaka lungsjukdomar som påminner om tuberkulos.[18]
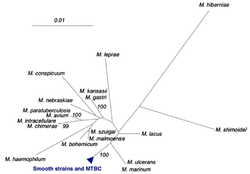
Evolution
Tuberkulos har en lång historia av samevolution med människan. Sjukdomen har definitivt förekommit hos oss i tusentals år, och kanske i miljoner år.[19] De äldsta mänskliga fossil som visar spår av tuberkulos är 9 000 år gamla.[20] Under den här utvecklingen har M. tuberculosis förlorat ett antal regioner i sitt genom, såväl kodande som icke-kodande DNA. Dessa förluster kan användas för att särskilja olika bakteriestammar. Olika stammar av M. tuberculosis förekommer i olika geografiska områden, så de genetiska skillnaderna kan användas för att spåra ursprung och spridning av en bakteriestam.[21]
Smitta
När en som lider av aktiv lungtuberkulos hostar, nyser, pratar, eller spottar, så utslungas små droppar (0,5-5 µm i diameter) som kan smitta. En enda nysning kan sprida upp till 40 000 droppar.[22] Varje droppe kan infektera en annan person, eftersom den dos som behövs för att starta en infektion är mycket liten, att andas in en enda bakterie kan räcka för att bli smittad.[23]
Personer med långvarig, frekvent eller intim kontakt med smittbärare löper särskilt hög risk att bli smittade, upp till 22% risk. En person med aktiv obehandlad tuberkulos kan smitta 10-15 andra personer om året.[2] Andra grupper som riskerar smitta är[24]
- de som bor i områden där tuberkulos är vanligt förekommande,
- sprutnarkomaner som injicerar under ohygieniska förhållanden
- de som bor eller arbetar under trångbodda förhållanden, med låga inkomster och med otillräcklig tillgång till sjukvård
- vissa minoritetsbefolkningar
- barn vars föräldrar tillhör högriskkategorier
- personer med nedsatt immunförsvar på grund av AIDS eller immunosuppressiva läkemedel
- vårdpersonal som vårdar patienter i högriskkategorier
Bara personer med aktiv tuberkulos är smittsamma, inte de som bär en latent infektion.[1] Sannolikheten för smitta beror på hur många smittsamma droppar den sjuke sprider omkring sig, hur bra ventilationen är, hur lång tid man blir utsatt för smitta, och hur smittsam den aktuella bakteriestammen är.[10] Smittkedjan kan därför brytas genom att isolera patienter med aktiv tuberkulos och ge dem effektiv antibiotikabehandling. Efter två veckors behandling är patienter normalt inte längre smittsamma, förutsatt att bakterierna inte är antibiotikaresistenta. Om man blir smittad tar det som regel tre till fyra veckor innan man i sin tur kan smitta andra.[25]
Tuberkulossmitta kan också spridas genom kött eller mjölk från infekterade kor.
Sjukdomsförlopp

Omkring 90% av de som infekterats med Mycobacterium tuberculosis får en asymtomatisk latent tuberkulosinfektion, med bara 10% sannolikhet att den latenta infektionen utvecklas till aktiv tuberkulossjukdom[1]. Men för dessa aktiva tuberkolusfall är dödligheten mer än 50% om de inte behandlas[26].
En tuberkulosinfektion börjar när bakterien når lungblåsorna, där den invaderar och förökar sig inuti endosomerna hos alveloära makrofager.[1][27]. Den primära infektionspunkten i lungorna kallas "Ghon-fokus" och ligger vanligtvis antingen i den övre delen av nedre lungloben, eller i nedre delen av den övre[1]. Bakterierna fångas upp av dendritiska celler, som inte tillåter dem att föröka sig, även om dessa celler kan transportera bakterierna till lokala mediastinala lymfnoder. Därifrån kan bakterierna sprida sig genom blodomloppet vidare till andra vävnader och organ där sekundära infektioner kan utvecklas. Vanliga platser för sekundärinfektion är andra delar av lungorna (särskilt toppen av övre lungloben), perifera lymfnoder, njurar, hjärna, och skelett[1][28]. Alla organ i kroppen kan drabbas av sjukdomen, men sällan hjärta, muskler, bukspottkörtel, och sköldkörtel[29].
Tuberkulos klassas som ett granulomatöst inflammatoriskt tillstånd. Makrofager, T-celler, B-celler och fibroblaster är bland de celler som samlas för att skapa ett granulom, där lymfocyterna omringar de infekterade makrofagerna. Granulomet inte bara hindrar bakterierna från att spridas, utan det tillhandahåller också en miljö där immunsystemets celler kan kommunicera. Inom granulomet utsöndrar T-celler (CD4+) cytokiner som gamma-interferon, som aktiverar makrofager för att förstöra bakterierna som de är infekterade med[30]. T-celler (CD8+) kan också direkt döda infekterade celler[27].
Det är viktigt att notera att bakterierna inte alltid elimineras i ett granulom, de kan istället komma i ett vilande tillstånd, vilket resulterar i en latent infektion.[1] Ett annat kännetecken på granulom i tuberkulos är celldöd (nekros) inuti tuberklerna. För ögat ser det döda materialet ut som mjuk vit ost.[31]
Om tuberkulosbakterier kommer ut i blodomloppet från den skadade vävnaden kan de sprida sig i kroppen och starta nya infektioner på många ställen, som alla visar sig som små vita tuberkler i vävnaden. Det här är en mycket allvarlig form av sjukdomen som kallas miliartuberkulos. Patienter med den här utbredda formen av tuberkulos har en dödlighet på 20% även med intensiv behandling.[32]
Hos många patienter kan sjukdomen gå fram och tillbaka, så att läkande och fibros balanserar vävnadsskador och nekros.[31] Den infekterade vävnaden ersätts av ärrvävnad och håligheter fyllda med det vita ostliknande nekrotiska materialet. När sjukdomen är aktiv öppnas en del av dessa håligheter mot luftkanalerna (bronkerna) i lungorna så att materialet kan hostas upp. Det innehåller levande bakterier och kan därför smitta omgivningen. Behandling med lämpliga antibiotika dödar bakterierna och låter vävnaden läkas. Men även när sjukdomen är helt botad finns fortfarande ärrvävnad kvar i det drabbade området.[31]
Diagnos
Tuberkulos diagnosticeras definitivt genom att identifiera mikroorganismen som orsakar sjukdomen i ett kliniskt prov, t.ex. slem eller var. När detta inte är möjligt kan en sannolik diagnos ställas genom lungröntgen och/eller tuberkulinprov.
Det främsta problemet med att diagnosticera tuberkulos är att bakterien är mycket svårodlad och förökar sig långsamt. En odling kan ta 4 till 12 veckor i laboratoriet. En komplett tuberkulosundersökning måste inkludera en medicinsk historia, en fysisk undersökning, en lungröntgen, och bakterieodling. Ett tuberkulinprov kan också ingå.
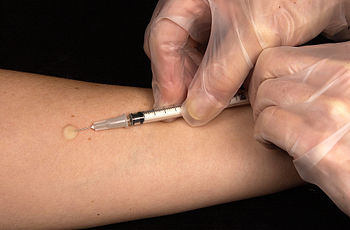
Tuberkulinprovet kallas också Mantoux-prov. Det är ett serologiskt prov som går till så att PPD injiceras under huden. Om detta ger en immunreaktion så har patienten antikroppar mot tuberkulos. Tolkningen av tuberkulinprovet beror på patientens riskfaktorer och eventuella immunproblem, och även på om patienten tidigare blivit vaccinerad mot tuberkulos med BCG-vaccin.[10]
Latent infektion diagnosticeras för närvarande i icke-vaccinerade personer genom tuberkulinprov, som då ger upphov till en fördröjd hypersensitivitetsreaktion.[1] De som är vaccinerade eller tidigare blivit botade från tuberkulos reagerar dock på samma sätt som infekterade, så testet måste tolkas med försiktighet, särskilt vad gäller personer från länder där vaccination är vanligt.[33] Tuberkulintest kan alltså producera falska positiva svar hos botade/vaccinerade personer, men även falska negativa svar förekommer, särskilt om patienten samtidigt lider av både tuberkulos och Hodgkins lymfom, sarkoidos, eller undernäring.[1] Nya typer av tuberkulintest håller på att utvecklas, i förhoppningen att man ska få fram test som är billiga, snabba och pålitligare. De inkluderar PCR-detektion av bakterie-DNA, och tester som mäter det gamma-interferon som utsöndras som svar på mykobakterieproteiner som ESAT-6.[34] Dessa test reagerar inte på vaccinerade personer, och inte heller på mykobakterier i den omgivande miljön, så de förväntas ge färre falska positiva prov.[35] Utvecklingen av snabba och billiga test skulle vara särskilt värdefulla i utvecklingsländer.[36]
Sjukdomsutveckling
Progression från latent infektion till aktiv tuberkulossjukdom inträffar när bakterierna övervinner immunsystemets försvar och börjar föröka sig. Vid primär tuberkulos (cirka 1-5% av fallen) händer detta bara en kort tid efter att man smittats.[1] I majoriteten av fallen leder dock smittan först till en latent infektion utan uppenbara symtom.[1] Latent tuberkulos utvecklas till aktiv sjukdom i 2-23% av fallen, ofta många år efter smittotillfället.[37] Risken för reaktivering av latent tuberkulos ökar vid svagheter i immunsystemet, till exempel hos HIV-positiva. Saminfektion med tuberkulos och HIV ökar risken att tuberkulosen aktiveras till 10% per år.[1][26]
Patienter med diabetes mellitus löper också högre risk att drabbas av aktiv tuberkulos,[38] och de svarar sämre på behandling på grund av sämre upptagning av medicin[39].
Andra omständigheter som ökar risken är:
- intravenöst drogmissbruk
- tidigare tuberkulosinfektion eller ofullständigt behandlad tuberkulossjukdom
- lungröntgen som visar spår av tidigare tuberkulos
- silikos
- långvarig kortikosteroidbehandling
- annan immunosuppressiv behandling
- cancer i huvud och hals
- hematologiska och retikulo-endoteliala sjukdomar, som leukemi och Hodgkins lymfom
- vissa njursjukdomar
- kroniska problem med malabsorption
- D-vitaminbrist[40]
- låg kroppsvikt[1][10]
Tvillingstudier under 1940-talet visade att mottaglighet för tuberkulos var ärftligt. Om en tvilling fick tuberkulos, så var risken större för den andra tvillingen om de var enäggstvillingar än tvåäggstvillingar.[41] Sedan dess har specifika genetiska polymorfismer i IL12B sammankopplats med tuberkulossusceptibilitet.[42]
Vissa läkemedel, bland annat mediciner mot reumatoid artrit som verkar genom att blockera cytokinet tumörnekrosfaktor-alfa, ökar risken för att en latent infektion aktiveras beroende på den betydelse detta cytokin har för immunsystemet.[43]
Behandling
Tuberkulos behandlas med antibiotika för att döda bakterierna. De två antibiotika som används mest är rifampicin och isoniazid. Mot andra sjukdomar brukar en kort antibiotikakur räcka, men vid tuberkulos krävs en mycket längre behandling, sex till tolv månaders kontinuerlig antibiotikabehandling, för att helt eliminera bakterierna ur kroppen .[10] Behandling av latent tuberkulos använder vanligtvis bara en sorts antibiotika, medan aktiv tuberkulos bäst behandlas med en kombination av flera (tre-fyra) sorter för att minska risken att bakterierna utvecklar resistens.[44] Människor med latent tuberkulos behandlas för att hindra att sjukdomen blir aktiv senare i livet. Behandling med Rifampicin och Pyrazinamide är dock inte ofarlig. CDC ändrade 2003 sina rekommendationer beträffande behandling av latent tuberkulos, på grund av allvarliga leverskador som alltför vanliga biverkningar.[45]
Antibiotikaresistens är ett vanligt problem vid tuberkulosbehandling. Resistenta bakterier sprids på samma sätt som vanliga tuberkulosbakterier. När en människa infekteras med redan resistenta bakterier kallas detta primär resistens. Hos en människa som smittats med normalt antibiotikakänsliga bakterier kan istället sekundär resistens utvecklas under antibiotikabehandling, särskilt om behandlingen inte genomförs fullt ut. Luckor och avbrott i den långvariga behandlingen, eller mediciner med låg kvalitet, underlättar resistensutveckling.[44] Det är därför mycket viktigt vid all antibiotikabehandling att nogsamt genomleva hela den föreskrivna behandlingen, även om man redan känner sig frisk. Detta är ett extra svårt problem för tuberkulos, eftersom behandlingen är så långvarig och kräver en kombination av flera dyra mediciner, och patienten kan vara omotiverad eftersom man känner sig frisk ganska snart efter att behandling påbörjats. I tredje världen är antibiotikaresistent tuberkulos ett allvarligt folkhälsoproblem, eftersom tuberkulos är vanligt förekommande och många fattiga inte har råd att ta de dyra medicinerna månader i sträck. Multiresistent tuberkulos (MDR-TB) definieras som resistens mot de två mest effektiva medicinerna mot ickeresistent tuberkulos: rifampicin och isoniazid. Det finns sex typer av "reservmediciner" att använda mot multiresistent tuberkulos, men vissa tuberkulosvarianter (XDR-TB) kan vara resistenta mot tre eller fler av dessa.[46]
Förr utfördes sk. kollapsterapi (gassprängning av lungtrakten) man lossade först lungan genom en operation, sedan stack man in en tjock nål mellan revbenen och gasade området där lungan normalt skulle ligga för att trycka ned den, ca. en gång i månaden i flera år. På detta sätt sattes lungan "ur bruk" och såren i den fick tid att läka. Kollapsterapi leder dock till livslång och kraftigt nedsatt lungfunktion, och behandlingen utförs knappt idag då den till skillnad från antibiotika inte botar sjukdomen utan bara lindrar förloppet.[47]
Prevention
Förebyggande och kontroll av tuberkulos sker längs två parallella spår. För det första ska tuberkulospatienters kontakter identifieras och behandlas, särskilt de som tillhör högriskgrupper. För det andra ska barn vaccineras för att skydda dem från tuberkulos. Tyvärr finns inget vaccin som ger pålitligt skydd för vuxna. I tropiska områden är dock andra arter av Mycobacterium ganska vanliga. Dessa orsakar normalt inte tuberkulos, men kan ändå stimulera vårt immunförsvar till att utveckla viss motståndskraft mot tuberkulos.[48]
Världshälsoorganisationen (WHO) förklarade tuberkulos för en global hälsofara 1993, och organisation "Stop TB Partnership" utvecklade en "Global Plan för att stoppa tuberkulos" som har som mål att räda 14 miljoner liv mellan 2006 och 2015.[49] Eftersom människan är det enda värddjuret för Mycobacterium tuberculosis skulle denna vara i princip möjlig att utrota, liksom smittkopporna utrotades, något som skulle underlättas enormt av ett effektivt vaccin.[50]
Vaccin
Många länder använder vaccinet Bacillus of Calmette and Guerin (BCG) som ett led i sin tuberkuloskontrollstrategi, särskilt för barn. Enligt WHO är detta det mest använda vaccinet i världen, med 85% av barnen i 172 länder vaccinerade 1993.[51] BCG var det första tuberkulosvaccinet, utvecklat vid Pasteurinstitutet i Frankrike mellan 1905 och 1921.[52] Massvaccinering av barn påbörjades dock inte förrän efter andra världskriget.[53] BCG ger ett skydd mot allvarliga former av tuberkulos hos barn, till exempel meningit, som är bättre än 80%, medan skyddet mot lungtuberkulos hos vuxna är mycket variabelt, från 0% till 80%.[54]
I Sydafrika, det land i världen som har den högsta förekomsten av tuberkulos, ges BCG-vaccin till alla barn före tre års ålder. [55] BCG är dock inte lika effektivt i områden där mykobakterier inte är så vanliga, och därför vaccineras inte alltid hela befolkningen i sådana länder. Den allmänna vaccination av alla barn i Sverige upphörde 1975, och nu erbjuds vaccination bara till den som tillhör särskilda riskgrupper.[56]
BCG-vaccinet ger som sagt hyggligt men inte fullständigt skydd för barn, och ganska dåligt skydd för vuxna. Det finns för närvarande fler tuberkulossmittade än någonsin förr på jorden, och de är därför synnerligen angeläget att ett nytt och mer effektivt vaccin utvecklas.[57]
Flera nya vacciner mot tuberkulos håller på att utvecklas. Det första vaccinet som bygger på rekombinant DNA-teknik, rBCG30, genomgår klinisk prövning i USA 2004.[58] En studie från 2005 visar att ett DNA-vaccin som ges tillsammans med reguljär antibiotikabehandling påskyndar tillfrisknandet och skyddar mot återinfektion hos möss, något som skulle kunna bli tillgängligt för människor om fyra eller fem år.[59] Ett mycket lovande vaccin, MVA85A, som baseras på genetiskt modifierade vaccinia-virus, befinner sig nu i klinisk prövning Fas II i Sydafrika,[60] Många andra strategier prövas också för att utveckla nya vacciner,[61] däribland både "subunit vaccines" (molekyler sammansatta av två rekombinanta proteiner som levereras i en adjuvant), som Hybrid-1, HyVac4 or M72, och rekombinanta adenovirus som Ad35.[62][63][64][65] Vissa av dessa vaccin kan effektivt ges utan nålar, vilket gör dem mer attraktiva i områden där HIV är vanligt.[66] Alla dessa vaccin har framgångsrikt testats hos människor, och undergår nu vidare prövning i områden med endemisk tuberkulos. För att uppmuntra fortsatt vaccinforskning studeras nya modeller för finansiering av vaccinutveckling, med priser, skatteincitament och förhandsbeställningar.[67][68]
Bill and Melinda Gates Foundation har varit en framträdande förkämpe för utveckling av tuberkulosvaccin. De tillkännagav 2007 ett bidrag på 200 miljoner dollar för klinisk prövning av upp till sex olika tuberkulosvaccin som är under utveckling.[69]
Epidemiologi
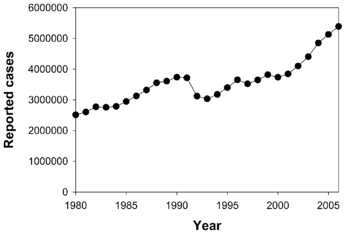
Enligt WHO har nästan två miljarder människor, en tredjedel av välrdens befolkning, blivit utsatta för tuberkulossmitta.[72] Årligen insjuknar 8 miljoner människor i tuberkulos, och 2 miljoner dör av sjukdomen i världen.[73] År 2004 hade omkring 14,6 miljoner människor aktiv tuberkulos, med 9 miljoner nya fall. Incidenstalet varierar från 356 per 100 000 i Afrika till 41 per 100 000 i Amerika.[2] Tuberkulos är den smittsamma sjukdom som dödar flest kvinnor i reproduktiv ålder och är den ledande dödsorsaken bland människor med HIV/AIDS.[74]
Ökningen av antalet HIV-smittade och försummelsen av tuberkuloskontrollprogram (vaccination av nyfödda ej längre rutin i många länder), har fått tuberkulos att åter öka kraftigt, efter årtionden av nedgång.[75] Uppkomsten av antibiotikaresistenta stammar av bakterierna har också bidragit till denna nya tuberkulosepidemi, med 20% av fallen resistenta mot standardbehandling och 2% resistenta även mor reservmediciner.[46] Incidenstalen för tuberkulos varierar stort över världen, ibland även mellan grannländer, uppenbarligen på grund av skillnader i hälso- och sjukvårdssystem.[76]
År 2005 var Swaziland det land som hade högsta incidenstalet för tuberkulos, med 1262 fall per 100 000 invånare. Indien har det största antalet fall i absoluta tal, med över 1,8 miljoner sjuka.[77] I i-länder är tuberkulos mindre vanligt, och är huvudsakligen ett storstadsfenomen. I Storbritannien varierar incidensen från 40 per 100 000 i London till mindre än fem per 100 000 i sydvästra Englands landsbygd;[78] det nationella genomsnittet är 13 per 100 000. De högsta talen i Västeuropa är i Portugal (31.1 per 100 000 år 2005) and Spanien (20 per 100 000). Det här kan jämföras med 113 per 100 000 i Kina och 64 per 100 000 i Brasilien. I USA är motsvarande siffra 4,9 per 100 000 år 2004.[73] I Kanada är tuberkulos fortfarande endemiskt i delar av Manitoba.[79] I både Sverige och Finland låg incidenstalet på 6 per 100 000 år 2005.[77]
Tuberkulosförekomsten varierar med ålder. I Afrika drabbar tuberkulos främst ungdomar och unga vuxna.[80] I länder där tuberkulos har bringats under kontroll på senare år, som USA, är tuberkulosdäremot främst en sjukdom hos äldre, eller personer med nedsatt immunförsvar.[1][81]
Det finns ett antal kända faktorer som gör människor mer mottagliga för tuberkulossmitta. Den viktigaste av dessa är HIV. Saminfektion med tuberkulos och HIV är särskilt ett problem i subsahariska Afrika, på grund av den mycket höga HIV-förekomsten där.[71][82] Att röka mer än 20 cigaretter om dagen ökar också risken för tuberkulos med två till fyra gånger.[83][84] Diabetes mellitus är även det en viktig riskfaktor som ökar i betydelse i utvecklingsländer.[85] Andra sjukdomar som ökar tuberkulosrisken är Hodgkins lymfom, kronisk njursjukdom, kronisk lungsjukdom, undernäring, och alkoholism.[1] Alkohol- och drogmissbruk är den vanligaste rapporterade faktorn i USA.[86]
Diet är också en faktor som kan påverka tuberkulosrisken. Till exempel bland indiska invandrare i London befanns hinduer med vegetarisk kost ha en 8,5 gånger ökad risk jämfört med muslimer som åt kött och fisk dagligen.[87] Även om ett orsakssamband inte är bevisat,[88] kan den ökade risken tänkas vara orsakad av brist på spårämnen, möjligen järn, vitamin B12 eller vitamin D.[87] Vidare studier har givit mer belägg för ett samband mellan D-vitaminbrist och tuberkulosrisk.[89][90] Globalt bidrar den allvarliga undernäringen i många utvecklingsländer till en kraftigt ökad risk att utveckla aktiv tuberkulos, på grund av att undernäringen försvagar immunsystemet.[91][92] Tillsammans med trångboddhet, kan undernäring bidra till det starka samband mellan tuberkulos och fattigdom som observerats.[93][94]
Historia

Tuberkulos har funnits hos människor sedan forntiden. De tidigaste otvetydiga spåren av Mycobacterium tuberculosis är i lämningar av en 17 000 år gammal bison.[95] Om tuberkulos har sitt ursprung hos boskap och överfördes till människor, eller om de två tuberkulosformerna har en gemensam förfader hos en tidigare art är för närvarande oklart.[96] Det är into desto mindre klarlagt att människans M. tuberculosis inte är en direkt avkomling till boskapens M. bovis, som tycks ha utvecklats relativt nyligen.[97]
Skelettrester visar hur förhistoriska människor under neolitisk tid hade tuberkulos[98], och spår av tuberkulos har också hittats i mumiers ryggrad från 3000-2400 F.Kr.[99] Phthisis är en grekisk term för tuberkulos. Hippokrates identifierade omkring 460 f.Kr. phthisis som den mest utbredda sjukdomen på den tiden, nästan alltid dödlig, med feber och blodiga upphostningar som symtom.[100] Genetiska studier indikerar att tuberkulos fanns i Sydamerika för 2000 år sedan.[101] I Sydamerika är de första spåren av tuberkulos kopplade till Paracaskulturen (750 f.Kr - 100 e.Kr.).[102]
Folktro
Före industriella revolutionen kunde tuberkulos ibland betraktas som en form av vampyrism. När en medlem av en familj dog av sjukdomen, hade andra i familjen redan smittats, och tynade i sin tur sakta bort. Folk trodde att detta berodde på att den ursprungligen sjuke sög ut livskraften från de andra. Dessutom fanns det likheter mellan tuberkulossymtom och traditionella vampyrattribut. Tuberkulosoffer har ofta röda svullna ögon (och är därigenom överkänsliga för ljus), blek hy, låg kroppsvärme, svagt hjärta, och blodig hosta.[103] Enligt en annan folktro berodde tuberkulos på att man tvingades delta i älvors nattliga riter, och därför tynade bort på grund av sömnbrist. Den här tron var vanligast där man såg en koppling mellan älvor och de döda.[104] På samma sätt, men inte lika vanligt, troddes tuberkulos kunde bero på att häxor använde offren som riddjur på natten, vilket återigen ledde till sömnbrist.[104]
Tuberkulos romantiserades under 1800-talet. Många trodde att tuberkulos orsakade euforiska känslor som kallades "Spes phthisica" eller "den tuberkulossjukes hopp". Man trodde att tuberkulossjuka som var artister fick utbrott av kreativitet allt eftersom sjukdomen fortskred, och även att de sjuka fick en sista energikick strax innan de dog som gjorde kvinnor vackrare och män mer kreativa.[105] Under tidigt 1900-tal trodde en del att tuberkulos orsakades av onani.[106]
Studier och behandling
Studiet av tuberkulos kan härledas åtminstone till Avicenna på 1020-talet. Han var den förste läkaren som identifierade lungtuberkulos som en smittosam sjukdom, den förste att upptäcka kopplingen till diabetes, och den förste att förslåt att tuberkulos kunde smitta genom kontakt med jord och vatten.[107][108] He developed the method of quarantine in order to limit the spread of tuberculosis.[109] I antiken fokuserades behandlingen på de drabbades diet. Plinius den äldre beskrev flera metoder i sin Naturhistoria: "varglever i tunt vin, späck från en sugga som har levt på gräs, eller köttet från en åsninna i buljong".[110]
Se även
Referenser
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; & Mitchell, Richard N. (2007). Robbins Basic Pathology (8th ed.). Saunders Elsevier. pp. 516-522 ISBN 978-1-4160-2973-1
- ↑ 2,0 2,1 2,2 2,3 2,4 [[World Health Organization]] (WHO).[http://www.who.int/mediacentre/factsheets/fs104/en/index.html Tuberculosis Fact sheet N°104 - Global and regional incidence.] March 2006, Retrieved on 6 October 2006.
- ↑ http://www.globalis.se/Statistik/Tuberkulosfall/(show)/table
- ↑ http://www.hjart-lungfonden.se/sv/Sjukdomar/Hjartsjukdomar/Tuberkulos/Mer-lasning/Tbc-laget-skapar-oro/
- ↑ http://www.msw.org.se/forelasning_Gunnar_boman_070926.htm
- ↑ http://www.lakartidningen.se/store/articlepdf/1/1870/LKT0535s00_02.pdf
- ↑ http://www.hjart-lungfonden.se/sv/Sjukdomar/Hjartsjukdomar/Tuberkulos/Hur-kan-man-sjalv-undvika-att-drabbas/
- ↑ http://www.ddss.nu/(S(ddpsoh45pheljl55tablc0nf))/swedish/means/latCauseOfDeath.aspx
- ↑ [http://www.aafp.org/afp/20051101/1761.html Extrapulmonary Tuberculosis: An Overview] MARJORIE P. GOLDEN, M.D., Yale University School of Medicine and Hospital of Saint Raphael, New Haven, Connecticut. HOLENARASIPUR R. VIKRAM, M.D., Mayo Clinic, Scottsdale, Arizona.
- ↑ 10,0 10,1 10,2 10,3 10,4 [[Centers for Disease Control and Prevention]] (CDC), Division of Tuberculosis Elimination. [http://www.cdc.gov/nchstp/tb/pubs/corecurr/default.htm Core Curriculum on Tuberculosis: What the Clinician Should Know.] 4th edition (2000). Updated August 2003.
- ↑ Cox R (2004). "Quantitative relationships for specific growth rates and macromolecular compositions of Mycobacterium tuberculosis, Streptomyces coelicolor A3(2) and Escherichia coli B/r: an integrative theoretical approach". Microbiology 150 (Pt 5): 1413–26. DOI:10.1099/mic.0.26560-0. PMID 15133103.
- ↑ 12,0 12,1 Madison B (2001). "Application of stains in clinical microbiology". Biotech Histochem 76 (3): 119–25. DOI:10.1080/714028138. PMID 11475314.
- ↑ Parish T, Stoker N (1999). "Mycobacteria: bugs and bugbears (two steps forward and one step back)". Mol Biotechnol 13 (3): 191–200. DOI:10.1385/MB:13:3:191. PMID 10934532.
- ↑ Niemann S, Rüsch-Gerdes S, Joloba ML, et al (September 2002). "Mycobacterium africanum subtype II is associated with two distinct genotypes and is a major cause of human tuberculosis in Kampala, Uganda". J. Clin. Microbiol. 40 (9): 3398–405. DOI:10.1128/JCM.40.9.3398-3405.2002. PMID 12202584.
- ↑ Niobe-Eyangoh SN, Kuaban C, Sorlin P, et al (June 2003). "Genetic biodiversity of Mycobacterium tuberculosis complex strains from patients with pulmonary tuberculosis in Cameroon". J. Clin. Microbiol. 41 (6): 2547–53. DOI:10.1128/JCM.41.6.2547-2553.2003. PMID 12791879.
- ↑ Thoen C, Lobue P, de Kantor I (February 2006). "The importance of Mycobacterium bovis as a zoonosis". Vet. Microbiol. 112 (2-4): 339–45. DOI:10.1016/j.vetmic.2005.11.047. PMID 16387455.
- ↑ Niemann S, Richter E, Dalügge-Tamm H, Schlesinger H, Graupner D, Königstein B, Gurath G, Greinert U, Rüsch-Gerdes S (2000). "Two cases of Mycobacterium microti derived tuberculosis in HIV-negative immunocompetent patients". Emerg Infect Dis 6 (5): 539–42. PMID 10998387.
- ↑ (1997) "Diagnosis and treatment of disease caused by nontuberculous mycobacteria. This official statement of the American Thoracic Society was approved by the Board of Directors, March 1997. Medical Section of the American Lung Association". Am J Respir Crit Care Med 156 (2 Pt 2): S1–25. PMID 9279284.
- ↑ Gutierrez MC, Brisse S, Brosch R, et al (September 2005). "Ancient origin and gene mosaicism of the progenitor of Mycobacterium tuberculosis". PLoS Pathog. 1 (1): e5. DOI:10.1371/journal.ppat.0010005. PMID 16201017.
- ↑ Hershkovitz I, Donoghue HD, Minnikin DE, et al. (2008). "Detection and molecular characterization of 9000-year-old Mycobacterium tuberculosis from a neolithic settlement in the eastern mediterranean". PLoS ONE 3 (10): e3426. DOI:10.1371/journal.pone.0003426.
- ↑ Rao K, Kauser F, Srinivas S, Zanetti S, Sechi L, Ahmed N, Hasnain S (2005). "Analysis of genomic downsizing on the basis of region-of-difference polymorphism profiling of Mycobacterium tuberculosis patient isolates reveals geographic partitioning". J Clin Microbiol 43 (12): 5978–82. DOI:10.1128/JCM.43.12.5978-5982.2005. PMID 16333085.
- ↑ Cole E, Cook C (1998). "Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies". Am J Infect Control 26 (4): 453–64. DOI:10.1016/S0196-6553(98)70046-X. PMID 9721404.
- ↑ Nicas M, Nazaroff WW, Hubbard A (2005). "Toward understanding the risk of secondary airborne infection: emission of respirable pathogens". J Occup Environ Hyg 2 (3): 143–54. DOI:10.1080/15459620590918466. PMID 15764538.
- ↑ Griffith D, Kerr C (1996). "Tuberculosis: disease of the past, disease of the present". J Perianesth Nurs 11 (4): 240–5. DOI:10.1016/S1089-9472(96)80023-2. PMID 8964016.
- ↑ [http://www.mayoclinic.com/health/tuberculosis/DS00372/DSECTION=3 ”Causes of Tuberculosis”]. [[Mayo Clinic]]. 2006-12-21. http://www.mayoclinic.com/health/tuberculosis/DS00372/DSECTION=3. Läst 2007-10-19.
- ↑ 26,0 26,1 Onyebujoh, Phillip and Rook, Graham A. W. [http://www.who.int/tdr/dw/tb2004.htm World Health Organization Disease Watch: Focus: Tuberculosis.] December 2004. Accessed 7 October 2006.
- ↑ 27,0 27,1 Houben E, Nguyen L, Pieters J (2006). "Interaction of pathogenic mycobacteria with the host immune system". Curr Opin Microbiol 9 (1): 76–85. DOI:10.1016/j.mib.2005.12.014. PMID 16406837.
- ↑ Herrmann J, Lagrange P (2005). "Dendritic cells and Mycobacterium tuberculosis: which is the Trojan horse?". Pathol Biol (Paris) 53 (1): 35–40. PMID 15620608.
- ↑ Agarwal R, Malhotra P, Awasthi A, Kakkar N, Gupta D (2005). "Tuberculous dilated cardiomyopathy: an under-recognized entity?". BMC Infect Dis 5 (1): 29. DOI:10.1186/1471-2334-5-29. PMID 15857515.
- ↑ Kaufmann S (2002). "Protection against tuberculosis: cytokines, T cells, and macrophages". Ann Rheum Dis 61 Suppl 2: ii54–8. PMID 12379623.
- ↑ 31,0 31,1 31,2 Grosset J (2003). "Mycobacterium tuberculosis in the extracellular compartment: an underestimated adversary". Antimicrob Agents Chemother 47 (3): 833–6. DOI:10.1128/AAC.47.3.833-836.2003. PMID 12604509.
- ↑ Kim J, Park Y, Kim Y, Kang S, Shin J, Park I, Choi B (2003). "Miliary tuberculosis and acute respiratory distress syndrome". Int J Tuberc Lung Dis 7 (4): 359–64. PMID 12733492.
- ↑ Rothel J, Andersen P (2005). "Diagnosis of latent Mycobacterium tuberculosis infection: is the demise of the Mantoux test imminent?". Expert Rev Anti Infect Ther 3 (6): 981–93. DOI:10.1586/14787210.3.6.981. PMID 16307510.
- ↑ Nahid P, Pai M, Hopewell P (2006). "Advances in the diagnosis and treatment of tuberculosis". Proc Am Thorac Soc 3 (1): 103–10. DOI:10.1513/pats.200511-119JH. PMID 16493157.
- ↑ Pai M, Zwerling A, Menzies D (June 2008). "Systematic Review: T-Cell-Based Assays for the Diagnosis of Latent Tuberculosis Infection: An Update". Ann. Intern. Med. 149 (3): 1–9. PMID 18593687.
- ↑ Reddy JR, Kwang J, Lechtenberg KF, Khan NC, Prasad RB, Chengappa MM (January 2002). "An immunochromatographic serological assay for the diagnosis of Mycobacterium tuberculosis". Comp. Immunol. Microbiol. Infect. Dis. 25 (1): 21–7. DOI:10.1016/S0147-9571(01)00016-9. PMID 11831744.
- ↑ Parrish N, Dick J, Bishai W (1998). "Mechanisms of latency in Mycobacterium tuberculosis". Trends Microbiol 6 (3): 107–12. DOI:10.1016/S0966-842X(98)01216-5. PMID 9582936.
- ↑ Restrepo BI (2007). "Convergence of the tuberculosis and diabetes epidemics: Renewal of old acquaintances". Clin Infect Dis 45: 436–438. DOI:10.1086/519939.
- ↑ Nijland HMJ, Ruslami R, Stalenhoef JE, et al. (2006). "Exposure to rifampicin is strongly reduced in patients with tuberculosis and type 2 diabetes". Clin Infect Dis 43 (7): 848–854. DOI:10.1086/507543. PMID 16941365.
- ↑ Nnoaham KE, Clarke A (2008). "Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis". Int J Epidemiol 37: 113–19. DOI:10.1093/ije/dym247. PMID 18245055.
- ↑ Kallmann FJ, Reisner D (1942). "Twin studies on the significance of genetic factors in tuberculosis". Am Rev Tuberc 16: 593–617.
- ↑ Tso HW, Lau YL, Tam CM, Wong HS, Chiang KS (2004). "Associations between IL12B polymorphisms and tuberculosis in the Hong Kong Chinese population". J Infect Dis 190 (5): 913–9. DOI:10.1086/422693. PMID 15295696.
- ↑ Mutlu G, Mutlu E, Bellmeyer A, Rubinstein I (2006). "Pulmonary adverse events of anti-tumor necrosis factor-alpha antibody therapy". Am J Med 119 (8): 639–46. DOI:10.1016/j.amjmed.2006.01.015. PMID 16887405.
- ↑ 44,0 44,1 O'Brien R (1994). "Drug-resistant tuberculosis: etiology, management and prevention". Semin Respir Infect 9 (2): 104–12. PMID 7973169.
- ↑ (2003) "Update: adverse event data and revised American Thoracic Society/CDC recommendations against the use of rifampin and pyrazinamide for treatment of latent tuberculosis infection—United States, 2003". MMWR Morb Mortal Wkly Rep 52 (31): 735–9. PMID 12904741.
- ↑ 46,0 46,1 (2006) "Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs—worldwide, 2000–2004". MMWR Morb Mortal Wkly Rep 55 (11): 301–5. PMID 16557213.
- ↑ http://norgeogverden.cappelen.no/n204ki07.htm
- ↑ Fine P, Floyd S, Stanford J, Nkhosa P, Kasunga A, Chaguluka S, Warndorff D, Jenkins P, Yates M, Ponnighaus J (2001). "Environmental mycobacteria in northern Malawi: implications for the epidemiology of tuberculosis and leprosy". Epidemiol Infect 126 (3): 379–87. DOI:10.1017/S0950268801005532. PMID 11467795.
- ↑ World Health Organization (WHO). Stop TB Partnership. Retrieved on 3 October 2006.
- ↑ Martin C (May 2006). "Tuberculosis vaccines: past, present and future". Curr Opin Pulm Med 12 (3): 186–91. DOI:10.1097/01.mcp.0000219267.27439.1b. PMID 16582673.
- ↑ WHO statement on BCG revaccination for the prevention of tuberculosis. Geneva: World Health Organization; 1995.
- ↑ Bonah C (2005). "The 'experimental stable' of the BCG vaccine: safety, efficacy, proof, and standards, 1921–1933". Stud Hist Philos Biol Biomed Sci 36 (4): 696–721. DOI:10.1016/j.shpsc.2005.09.003. PMID 16337557.
- ↑ Comstock G (1994). "The International Tuberculosis Campaign: a pioneering venture in mass vaccination and research". Clin Infect Dis 19 (3): 528–40. PMID 7811874.
- ↑ Bannon M (1999). "BCG and tuberculosis". Arch Dis Child 80 (1): 80–3. DOI:10.1136/adc.80.1.80. PMID 10325767.
- ↑ WHO/UNICEF Review of National Immunization Coverage 1980–2005: South Africa (PDF). World Health Organization (August 2006). Retrieved on 2007-06-08.
- ↑ http://www.orebroll.se/upload/Prim/Kansli/BHV/Dokument/Handboken/Kap%2011.18.%201.%20Tuberkulos%20(BCG)%20-%20vaccination.pdf
- ↑ Sadoff, Jerry. Advances in Tuberculosis Vaccine Strategies. Nature Reviews Microbiology. Vol. 4. June 2006.
- ↑ National Institute of Allergy and Infectious Diseases (NIAID).First U.S. Tuberculosis Vaccine Trial in 60 Years Begins. National Institutes of Health News 26 January 2004. Retrieved on 19 October 2007.
- ↑ Ha S, Jeon B, Youn J, Kim S, Cho S, Sung Y (2005). "Protective effect of DNA vaccine during chemotherapy on reactivation and reinfection of Mycobacterium tuberculosis". Gene Ther 12 (7): 634–8. DOI:10.1038/sj.gt.3302465. PMID 15690060.
- ↑ Ibanga H, Brookes R, Hill P, Owiafe P, Fletcher H, Lienhardt C, Hill A, Adegbola R, McShane H (2006). "Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis-endemic countries: issues in study design". Lancet Infect Dis 6 (8): 522–8. DOI:10.1016/S1473-3099(06)70552-7. PMID 16870530.
- ↑ Doherty TM, Andersen P (October 2005). "Vaccines for Tuberculosis: Novel Concepts and Recent Progress" (PDF). Clinical Microbiology Reviews 18 (4): 687–702. DOI:10.1128/CMR.18.4.687–702.2005. Hämtat 2009-03-01.
- ↑ ”Vaccine Research - Tuberculosis”. Statens Serum Institut. http://www.ssi.dk/sw13853.asp. Läst 2009-03-01.
- ↑ ”Statens Serum Institut (SSI), Intercell (ICLL), and Aeras Global Tuberculosis Vaccine Foundation (Aeras) announce the initiation of a clinical trial for a novel vaccine candidate”. Aeras. December 4, 2007. http://www.aeras.org/newscenter/news-detail.php?id=705. Läst 2009-03-01.
- ↑ ”Vaccine Discovery — Overview”. Aeras. http://www.aeras.org/our-approach/vaccine-development.php?discovery-overview. Läst 2009-03-01.
- ↑ ”Tuberculosis Vaccine”. Crucell. http://www.crucell.com/R_and_D-Clinical_Development-Tuberculosis_Vaccine. Läst 2009-03-01.
- ↑ Dietrich J, Andersen C, Rappuoli R, Doherty TM, Jensen CG, Andersen P (2006). "Mucosal Administration of Ag85B-ESAT-6 Protects against Infection with Mycobacterium tuberculosis and Boosts Prior Bacillus Calmette-Guérin Immunity" (PDF). Journal of Immunology 177: 6353–6360. Hämtat 2009-03-01.
- ↑ Webber, David and Kremer, Michael. Stimulating Industrial R&D for Neglected Infectious Diseases: Economic Perspectives (PDF). Bulletin of the World Health Organization 79(8), 2001, pp. 693–801.
- ↑ Barder, Owen; Kremer, Michael; Williams, Heidi. "Advance Market Commitments: A Policy to Stimulate Investment in Vaccines for Neglected Diseases," The Economists' Voice, Vol. 3 (2006) Issue 3.
- ↑ Aeras Receives New Grant from the Gates Foundation
- ↑ Världshälsoorganisationen (WHO) WHO report 2008: Global tuberculosis control Retrieved on 13 April 2009.
- ↑ 71,0 71,1 Världshälsoorganisationen (WHO). Global tuberculosis control - surveillance, planning, financing WHO Report 2006. Retrieved on 13 October 2006.
- ↑ National Institute of Allergy and Infectious Diseases (NIAID). [1] 26 October 2005. Retrieved on 3 October 2006. "According to the World Health Organization (WHO), nearly 2 billion people, one-third of the world's population, have TB."
- ↑ 73,0 73,1 Centers for Disease Control. Fact Sheet: Tuberculosis in the United States. 17 March 2005, Retrieved on 6 October 2006.
- ↑ Stop TB Partnership. London tuberculosis rates now at Third World proportions. PR Newswire Europe Ltd. 4 December 2002. Retrieved on 3 October 2006.
- ↑ Iademarco MF, Castro KG (2003). "Epidemiology of tuberculosis". Seminars in respiratory infections 18 (4): 225–40. DOI:10.1017/S0950268801005532. PMID 14679472.
- ↑ Sobero R, Peabody J (2006). "Tuberculosis control in Bolivia, Chile, Colombia and Peru: why does incidence vary so much between neighbors?". Int J Tuberc Lung Dis 10 (11): 1292–5. PMID 17131791.
- ↑ 77,0 77,1 Global tuberculosis control: surveillance, planning, financing. WHO report 2007. Geneva, World Health Organization (WHO/HTM/TB/2007.376)
- ↑ Notification rates of tuberculosis: by NHS Regional Office area, 1990-2001: Regional Trends 37 Office for National Statistics Retrieved on 13 October 2006.
- ↑ http://gateway.nlm.nih.gov/MeetingAbstracts/ma?f=102188560.html
- ↑ World Health Organization (WHO). Global Tuberculosis Control Report, 2006 - Annex 1 Profiles of high-burden countries. (PDF) Retrieved on 13 October 2006.
- ↑ Centers for Disease Control and Prevention (CDC). 2005 Surveillance Slide Set. (12 September 2006) Retrieved on 13 October 2006.
- ↑ Chaisson RE, Martinson NA (2008). "Tuberculosis in Africa—combating an HIV-driven crisis". N Engl J Med 358 (11): 1089–1092. DOI:10.1056/NEJMp0800809. PMID 18337598.
- ↑ Davies PDO, Yew WW, Ganguly D, et al. (2006). "Smoking and tuberculosis: the epidemiological association and pathogenesis". Trans R Soc Trop Med Hyg 100: 291–8. DOI:10.1016/j.trstmh.2005.06.034. PMID 16325875.
- ↑ Jha P, Jacob B, Gajalakshmi V, et al. (2008). "A nationally representative case–control study of smoking and death in India". N Engl J Med 358 (11): 1137–1147. DOI:10.1056/NEJMsa0707719. PMID 18272886.
- ↑ Restrepo BI (August 2007). "Convergence of the tuberculosis and diabetes epidemics: renewal of old acquaintances". Clin. Infect. Dis. 45 (4): 436–8. DOI:10.1086/519939. PMID 17638190.
- ↑ http://archinte.ama-assn.org/cgi/content/short/169/2/189
- ↑ 87,0 87,1 Strachan DP, Powell KJ, Thaker A, Millard FJ, Maxwell JD (1995-02). "Vegetarian diet as a risk factor for tuberculosis in immigrant south London Asians". Thorax 50 (2): 175–80. DOI:10.1136/thx.50.2.175. PMID 7701458.
- ↑ Davis L (August 1995). "Vegetarian diet and tuberculosis in immigrant Asians". Thorax 50 (8): 915–6. DOI:10.1136/thx.50.8.915-c. PMID 7570453.
- ↑ Ustianowski A, Shaffer R, Collin S, Wilkinson RJ, Davidson RN (June 2005). "Prevalence and associations of vitamin D deficiency in foreign-born persons with tuberculosis in London". The Journal of infection 50 (5): 432–7. DOI:10.1016/j.jinf.2004.07.006. PMID 15907552.
- ↑ Nnoaham KE, Clarke A (February 2008). "Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis". International journal of epidemiology 37 (1): 113–9. DOI:10.1093/ije/dym247. PMID 18245055.
- ↑ Schaible UE, Kaufmann SH (May 2007). "Malnutrition and infection: complex mechanisms and global impacts". PLoS medicine 4 (5): e115. DOI:10.1371/journal.pmed.0040115. PMID 17472433.
- ↑ Lönnroth K, Raviglione M (October 2008). "Global epidemiology of tuberculosis: prospects for control". Seminars in respiratory and critical care medicine 29 (5): 481–91. DOI:10.1055/s-0028-1085700. PMID 18810682.
- ↑ Davies PD (2003). "The world-wide increase in tuberculosis: how demographic changes, HIV infection and increasing numbers in poverty are increasing tuberculosis". Annals of medicine 35 (4): 235–43. DOI:10.1080/07853890310005713. PMID 12846265.
- ↑ Spence DP, Hotchkiss J, Williams CS, Davies PD (September 1993). "Tuberculosis and poverty". BMJ (Clinical research ed.) 307 (6907): 759–61. DOI:10.1136/bmj.307.6907.759. PMID 8219945.
- ↑ Rothschild B, Martin L, Lev G, Bercovier H, Bar-Gal G, Greenblatt C, Donoghue H, Spigelman M, Brittain D (2001). "Mycobacterium tuberculosis complex DNA from an extinct bison dated 17,000 years before the present". Clin Infect Dis 33 (3): 305–11. DOI:10.1086/321886. PMID 11438894.
- ↑ Pearce-Duvet J (2006). "The origin of human pathogens: evaluating the role of agriculture and domestic animals in the evolution of human disease". Biol Rev Camb Philos Soc 81 (3): 369–82. DOI:10.1017/S1464793106007020. PMID 16672105.
- ↑ Ernst JD, Trevejo-Nuñez G, Banaiee N (July 2007). "Genomics and the evolution, pathogenesis, and diagnosis of tuberculosis". J. Clin. Invest. 117 (7): 1738–45. DOI:10.1172/JCI31810. PMID 17607348.
- ↑ Hershkovitz I, Donoghue HD, Minnikin DE, Besra GS, Lee OY-C, et al. (15 October 2008). "Detection and Molecular Characterization of 9000-Year-Old Mycobacterium tuberculosis from a Neolithic Settlement in the Eastern Mediterranean.". PLoS ONE 3 (10): e3426. DOI:10.1371/journal.pone.0003426.
- ↑ Zink A, Sola C, Reischl U, Grabner W, Rastogi N, Wolf H, Nerlich A (2003). "Characterization of Mycobacterium tuberculosis complex DNAs from Egyptian mummies by spoligotyping". J Clin Microbiol 41 (1): 359–67. DOI:10.1128/JCM.41.1.359-367.2003. PMID 12517873.
- ↑ Hippocrates. Aphorisms. Accessed 7 October 2006.
- ↑ Konomi N, Lebwohl E, Mowbray K, Tattersall I, Zhang D (2002). "Detection of mycobacterial DNA in Andean mummies". J Clin Microbiol 40 (12): 4738–40. DOI:10.1128/JCM.40.12.4738-4740.2002. PMID 12454182.
- ↑ "South America: Prehistoric Findings". Memorias do Instituto Oswaldo Cruz, Vol. 98 (Suppl.I) January 2003. Retrieved on 2007-02-08.
- ↑ Sledzik P, Bellantoni N (1994). "Brief communication: bioarcheological and biocultural evidence for the New England vampire folk belief". Am J Phys Anthropol 94 (2): 269–74. DOI:10.1002/ajpa.1330940210. PMID 8085617.
- ↑ 104,0 104,1 Katharine Briggs, An Encyclopedia of Fairies "Consumption" (Pantheon Books, 1976) p. 80. ISBN 0-394-73467-X
- ↑ Lawlor, Clark. "Transatlantic Consumptions: Disease, Fame and Literary Nationalism in the Davidson Sisters, Southey, and Poe". Studies in the Literary Imagination, Fall 2003. Available at findarticles.com. Retrieved on 2007-06-08.
- ↑ Laumann, Edward O. (1994) The Social Organization of Sexuality: Sexual Practices in the United States University of Chicago Press p 80, ISBN 0-22647-020-2
- ↑ Y. A. Al-Sharrah (2003), "The Arab Tradition of Medical Education and its Relationship with the European Tradition", Prospects 33 (4), Springer.
- ↑ George Sarton, Introduction to the History of Science.
(cf. Dr. A. Zahoor and Dr. Z. Haq (1997). Quotations From Famous Historians of Science, Cyberistan.) - ↑ David W. Tschanz, MSPH, PhD (August 2003). "Arab Roots of European Medicine", Heart Views 4 (2).
- ↑ Pliny the Elder, Natural History, quoted at Naphtali Lewis, Meyer Reinhold. ”Roman Civilization”. http://books.google.com/books?id=GO8tcTpgj-0C.
Externa länkar
- ”Tuberkulos – tbc”. Sjukvårdsrådgivningen. http://www.sjukvardsradgivningen.se/artikel.asp?CategoryID=21237.
- Denna artikel är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Tuberculosis