Guld
Från Rilpedia
|
|||||||||||||||||||||||||||||||||||||
| Allmänt | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
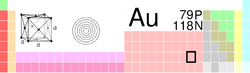
| Namn, kemiskt tecken, nummer | guld, Au, 79 | ||||||||||||||||||||||||||||||||||||
| Ämnesklass | övergångsmetaller | ||||||||||||||||||||||||||||||||||||
| Grupp, period, block | 11, 6, d | ||||||||||||||||||||||||||||||||||||
| Densitet | 19 300 kg/m3 (273 K) | ||||||||||||||||||||||||||||||||||||
| Utseende | metalliskt gul |
||||||||||||||||||||||||||||||||||||
| Atomens egenskaper | |||||||||||||||||||||||||||||||||||||
| Atommassa | 196,96655 u | ||||||||||||||||||||||||||||||||||||
| Atomradie (beräknad) | 135 pm | ||||||||||||||||||||||||||||||||||||
| Kovalent radie | 144 pm | ||||||||||||||||||||||||||||||||||||
| van der Waalsradie | 166 pm | ||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Xe]4f145d106s1 | ||||||||||||||||||||||||||||||||||||
| e− per skal | 2, 8, 18, 32, 18, 1 | ||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd (oxid) | 3, 1 (neutral) | ||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisk (ccp) | ||||||||||||||||||||||||||||||||||||
| Ämnets fysiska egenskaper | |||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | fast | ||||||||||||||||||||||||||||||||||||
| Smältpunkt | 1337,15 K (1064 °C) | ||||||||||||||||||||||||||||||||||||
| Kokpunkt | 3080,15 K (2807 °C) | ||||||||||||||||||||||||||||||||||||
| Molvolym | 10,21 ·10−6 m3/mol | ||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 334,4 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Smältvärme | 12,55 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Ångtryck | 0,000237 Pa vid 1337 K | ||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 1740 m/s vid 293,15 K | ||||||||||||||||||||||||||||||||||||
| Diverse | |||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 2,54 (Paulingskalan) | ||||||||||||||||||||||||||||||||||||
| Värmekapacitet | 128 J/(kg·K) | ||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsförmåga | 45,5 · 106 S/m (Ω−1·m−1) | ||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 317 W/(m·K) | ||||||||||||||||||||||||||||||||||||
| 1a jonisationspotential | 890,1 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2a jonisationspotential | 1980 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Mest stabila isotoper | |||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
| SI-enheter & STP används om ej annat angivits | |||||||||||||||||||||||||||||||||||||
Guld (latinskt namn Aurum) är ett grundämne som tillhör gruppen ädelmetaller och gruppen myntmetaller samt är ett mineral. Guld har det kemiska tecknet Au som kommer av aurum, det latinska ordet för guld. Det är en eftertraktad metall vilken under århundraden har använts som betalningsmedel, som värdebeständig tillgång, och som smycken. Metallen finns som korn och klumpar i berggrunden, i underjordiska ådror och i guldrik alluvialjord. Guld är kompakt, mjukt, glänsande och den mest formbara och tåliga av alla kända metaller. Rent guld har en klart gul färg som traditionellt har ansetts tilltalande.
Guld är bas för den monetära standard som använts av Internationella valutafonden (IMF) och Bank for International Settlements (BIS). ISO:s valutakod för guldtackor är XAU. Vid avräkning mellan telefonförvaltningar för internationella samtal används av alla länder taxor satta i guldfranc som gemensam värdebeständig jämförelsevaluta. (Se vidare Internationella Teleunionen.)
Modern användning inom industrin inkluderar produkter som används inom tandvård och elektronik, där guld traditionellt har använts på grund av dess goda resistens mot oxiderande korrosion.[1]
Guld var den 20 januari 2009 värt cirka 225 kr/g, eller 828 USD/oz. Ett troy oz, som ädelmetaller mäts i, är cirka 31,10348 g.
Innehåll |
Fysikaliska och kemiska egenskaper
Kompakt guld utmärker sig genom sin karakteristiska gula färg och starka glans. Kompakt guld har densiteten 19,3 g/cm³ och hör till de bästa ledarna för elektricitet. Guld har atomvikten 196,97 och metallen uppträder som en- och trevärd. Guldet har mycket svårt att förena sig med syre, oavsett temperatur. På grund av detta hör guldet till de ädlaste metaller som finns.
Historik
Medeltiden
Maliriket i Afrika var känt över hela den gamla världen på grund av de stora mängderna guld. Mansa Musa, härskare över riket (1312-1337) blev känd på grund av hans extravaganta hajj till Mecka år 1324.Mansa Musa. Läst 2007-12-09.
Nya tiden
Under medeltiden gick den europeiska guldproduktionen starkt ned. De flesta människor från Europa sökte sig till Mexiko och Brasilien, som under 1700-talet lämnade större delen av allt guld som producerades i världen. Under tiden 1691-1800 kom från Brasilien guld till omkring 2,115 miljoner kronors värde. Betydande guldmängder träffades redan tidigt i Peru, där inkariket samlat kolossala, sedermera av spanjorerna rövade skatter, vidare i Chile och Colombia.
1800-talet
I början av 1800-talet gick guldproduktionen ned till ett relativt minimum, tills återupptäckten av de givande alluviallagren på östra sluttningen av Uralbergen medförde en ny ökning. 1845 var Rysslands guldproduktion nästan dubbelt så stor som Sydamerikas. Ett ännu större uppsving medförde upptäckten av Kaliforniens och Australiens guldrika svämlager (1848 och 1851). Efter utvaskningen av de rikaste lagren började man bryta de mäktiga guldförande kvartsgångarna på Sierra Nevadas väst- och östsluttningar. Den berömda Comstockgången lämnade 1860-75 för 300 miljoner kronor guld. Kalifornien lämnade redan första året för 38 miljoner kronor guld, och produktionen uppnådde 1853 sitt maximum med 246 miljoner kr. Sedan dess har Kaliforniens guldproduktion alltjämt sjunkit och är numera knappast nämnvärd. Australiens guldproduktion nådde sin höjdpunkt i Victoria 1857 med omkring 88 ton. 1891 hade den gått ned där till 18 ton. Nästa för världsproduktionen betydande guldfynd gjordes i Transvaal 1882-86. Dessutom upptäcktes de rika guldfälten vid Klondike och Yukonfloden 1896. 1897 lämnade de för 9 miljoner, 1898 för 30 miljoner och 1900 för 73 miljoner av den ädla metallen.
Fynd av guldföremål
Enskilda personers fynd av guldföremål i fornlämningar i Sverige skall enligt lag obligatoriskt erbjudas staten för inlösen.
Användning
I industrin används guld bland annat av juvelerare och guldsmeder, urmakare, galvanoplastiker, förgyllare, glas- och porslinsfabrikanter, tandtekniker och fotografer. Bland förgyllningsmetoder (se förgyllning) har den galvaniska största betydelsen.
Ämnet är godkänt som livsmedelstillsats med E-nummer E 175.
Guld har en konduktivitet – elektrisk ledningsförmåga – som är högre än de flesta metaller, men lägre än till exempel koppar. Dess renhet och beständighet mot oxidation, och möjligheten att göra mycket tunna trådar, gör att man vanligen har guldplätering vid kontaktytor. Guldplätering används frekvent inom telekom och HiFi-produkter. Tyvärr drabbas pläteringen av nötning, då guld är relativt mjukt jämfört med andra ädelmetaller.
Guld har använts till smycken sedan förhistorisk tid, i Sverige i minst 1 600 år. På Historiska museet i Stockholm kan en sjuringad halskrage från Möne i Västergötland, daterad till 400-talet e.Kr. beskådas tillsammans med andra arkeologiska guldföremål från tiden 350-500 e.Kr.
Källor
 Denna artikel är helt eller delvis baserad på material från Nordisk familjebok, 1904–1926 (Not).
Denna artikel är helt eller delvis baserad på material från Nordisk familjebok, 1904–1926 (Not).
Noter
- ↑ Översatt från engelskspråkiga Wikipedia. Läst 2007-12-09.
Se även
- Periodiska systemet
- Alkemi
- Guldmedalj
- Guldsmed
- Gulddragare
- Guldrusch
- Investeringsguld
- Kungsvatten
- Karat
- Mineral
Externa länkar
 Wikimedia Commons har media som rör Guld
Wikimedia Commons har media som rör Guld