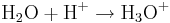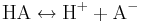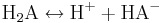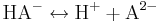Syra
Från Rilpedia
- För andra betydelser, se Syra (olika betydelser).
En syra definieras som ett ämne som kan avge protoner (eller vätejoner). Många ämnen har förmågan att kunna avge protoner, men i större eller mindre utsträckning. Man delar därför in syror i olika grupper beroende på hur många protoner de kan avge i en lösning (oftast iakttaget i vattenlösning). Citronsyran har inte så stor benägenhet att avge protoner och kan därför ses som en svag syra, medan saltsyra avger alla sina protoner och ses då som en stark syra. Det finns även syror som kan betecknas som medelstarka syror; en sådan är fosforsyra.
Syrans styrka anges av en syrakonstant, en form av jämviktskonstant. En syra kan tillsammans med en korresponderande bas bilda ett buffertsystem.
Innehåll |
Lewis- och Brønstedsyror
En mer generell teori, av betydelse framför allt inom organisk kemi, har formulerats av Gilbert Newton Lewis. Enligt denna är en syra en elektronparsacceptor och en bas en elektronparsdonator.
I Johannes Brønsteds teori anger protoner egentligen vätekärnor, det vill säga de protonerna kan åtföljas av en eller två neutroner, eftersom väteatomens kärna kan ha dessa olika uppbyggnader. Eftersom väteatomen ju endast har en elektron, kommer H+ att innebära en jon utan några som helst elektroner. Denna lilla partikel får då speciella egenskaper. Bland annat förekommer den under normala förhållanden endast momentant som enskild partikel, och tas upp mycket snabbt av någon bas i närheten. Så är till exempel i vattenlösning alla avgivna protoner bundna till vattenmolekyler som hydroniumjoner:
Dessa hydroniumjoner beteckas inom protolyskemin oftast (oegentligt) som vätejoner. Vanligen särskiljer man dock inte hydroniumjoner från vätejoner i till exempel kemiska jämviktsberäkningar. Samtliga betraktas då som vätejoner, H+ (detta är möjligt eftersom aktiviteten för H2O vanligen sätts till 1 enligt konvention).
I sur lösning överväger hydroniumjonerna ("vätejonerna") över hydroxidjonerna.
En- och flerprotoniga syror
En enprotonig syra kan endast dissociera i ett steg. För den enprotoniga syran HA ser dess protolys ut så här:
Till denna reaktion hör en syrakonstant; för definitionen av denna, se under jämviktskonstant. Exempel på enprotoniga syror är saltsyra, HCl, och salpetersyra, HNO3.
Tvåprotoniga syror dissocierar i två steg. För den tvåprotoniga syran H2A får vi:
Kolsyra, H2CO3, och svavelsyra, H2SO4, är två viktiga exempel. Det finns även treprotoniga syror som dissocierar i tre steg; fosforsyra, H3PO4, är en sådan. För flerprotoniga syror krävs flera syrakonstanter för att beskriva reaktionen.
Organiska syror
Organiska syror är organiska föreningar som samtidigt är syror. De vanligaste, karboxylsyrorna, är svaga. Andra viktiga organiska syror är askorbinsyra eller vitamin C samt de något starkare sulfonsyrorna. Några vanliga organiska syror är äppelsyra och citronsyra som finns i frukter, acetylsalicylsyra som finns i läkemedel och stearinsyra som finns i stearinljus.
Syrors egenskaper
- Smakar ofta, men inte alltid, surt
- Ger en stickande känsla vid kontakt med hud
- Bildar koldioxid tillsammans med karbonatföreningar
- Bildar vätgas och en saltlösning med oädla metaller
- Vattenlösningar av syror leder elektrisk ström