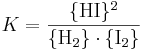Kemisk jämvikt
Från Rilpedia
Kemisk jämvikt är då en kemisk reaktion äger rum med samma reaktionshastighet som dess motsatta reaktion; reaktionshastigheten för den framåtskridande och den bakåtskridande reaktionen är lika, och koncentrationen av reaktanter och produkter är konstant. När detta skett, sker ingen förändring i proportionen, d.v.s. koncentrationerna hos de olika föreningarna, och det verkar som om reaktionen upphör att fortskrida. Dock fortsätter det framåt- och bakåtskridande reaktionerna att äga rum vid samma hastighet. Utan tillsatt energi, fortsätter alltid en kemisk reaktion till dess att en jämvikt uppnåtts. Kemisk jämvikt är ett exempel på dynamisk jämvikt.
Ett vanligt exempel på en kemisk jämvikt är Haber–Bosch-metoden, där väte och kväve bildar ammoniak. Jämvikten nås då hastigheten av bildandet av ammoniak är lika stor som dess dekomposition.
Innehåll |
Jämviktspilar
Anta att a mol av ämnet A reagerar med b mol av ämnet B och bildar c mol av ämnet C samt d mol av ämnet D. För att visa att en reaktionsformel för denna reaktion är i jämvikt används en dubbel reaktionspil istället för en enkel reaktionspil (→). Det finns två typer av dubbla reaktionspilar som används: Dubbelpilen (Dubbel reaktionspil, U+21C4) eller "dubbelharpunen" ("Dubbelharpun", U+21CC):
- aA + bB Dubbel reaktionspil cC + dD
eller
- aA + bB "Dubbelharpun" cC + dD
Dubbelpil används, enligt The Chicago Manual of Style (14:e utgåvan, s. 454–455), för att beteckna en Jämviktsreaktion med början till vänster, samtidigt som "Dubbelharpun" betecknar en reversibel reaktion med början till vänster. De båda piltyperna kan även användas spegelvänt, beroende på var reaktionen börjar.
Då jämvikt råder finns ett konstant förhållande mellan produkternas (C och D) och reaktanternas (A och B) aktiviteter. Detta tillstånd beskrivs av jämviktskonstanten.
Olika typer av jämvikter
Kemiska jämvikter kan delas upp i homogena jämvikter och heterogena jämvikter.
Heterogena jämvikter
Heterogena jämvikter är jämvikter mellan ämnen i olika faser, såsom mellan ett fast ämne och dess upplösta form.
Homogena jämvikter
Homogena jämvikter äger rum i samma fas, vilket i de vanligaste fallen innebär att samtliga deltagande ämnen är gaser (gasjämvikter), eller alla upplösta i samma vätska, men även fasta jämvikter är tänkbara, även om reaktionerna är betydligt långsammare än i de övriga fallen.
Som exempel på gasjämvikter brukar jämvikten nedan ges:
- H2 + I2 Dubbelpil 2HI
Samtliga tre ämnen är här gaser. Reaktionen från vänster går fortare ju större koncentration dessa båda ämnen har, medan reaktionen från höger går fortare ju större koncentration vätejodid har. Dessa båda reaktioner motverkar varandra, och när jämvikt uppnåtts, går reaktionerna åt båda håll lika fort.
Förhållandet mellan produkter och reaktanter i den här reaktionen kan beskrivas med en jämviktskonstant som definieras på följande sätt: