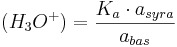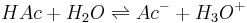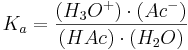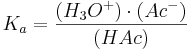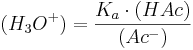Buffertsystem
Från Rilpedia
Ett buffertsystem, även kallat buffert eller buffertlösning om buffertsystemet är en kemikalie, består vanligtvis av en svag syra samt dess korresponderande bas i jämförbara koncentrationer, till exempel ättiksyra och något acetatsalt. Buffertsystemet gör att pH-värdet ändras mycket lite vid tillsats av måttliga mängder av en annan syra eller bas, genom att den tillsatta syran reagerar med buffertsystemets bas respektive att den tillsatta basen reagerar med buffertsystemets syra. En buffert håller också pH-värdet ungefärligen konstant vid spädning med vatten. Buffertverkan är störst omkring syrans pKa-värde.
Buffertsystem i levande vävnad
I levande vävnad förhindrar buffertsystem kraftiga pH-omsvängningar som annars skulle leda till att vävnaden dör, eftersom kemiska reaktioner i levande varelser ofta är pH-beroende. Exempel på naturliga buffertlösningar är senap och blod.
Eftersom buffertsystem kan reagera med både hydroniumjoner och hydroxidjoner, förhindrar de att halterna av dessa jonslag förändras i någon större utsträckning i till exempel människokroppens vätskor. Om en droppe koncentrerad saltsyra skulle tillsättas en liter rent vatten skulle koncentrationen hydroniumjoner stiga ungefär 10 000 gånger. Om man skulle tillsätta samma mängd saltsyra med samma koncentration till en liter blod skulle hydroniumjonkoncentrationen ändras med mindre än 1 %.
Detta visar hur effektivt buffertsystem blod har och hur viktigt det är för levande varelser. Det mänskliga blodet har ett pH-värde på 7,4; om detta värde faller under 7,0 eller överstiger 7,8 skulle ett livshotande tillstånd råda.
Några vanliga buffertsystem
Beräkningar med buffertsystem
Vid beräkningar av buffertsystem kan man utnyttja formeln för syrans syrakonstant. Som exempel kan vi ta att syran HAc blandas med vatten (H2O). Då sker följande reaktion:
Formeln för syrakonstanten blir då:
där
- (H3O+) = hydroniumjonens aktivitet.
- (A-) = basens aktivitet.
- (HAc) = syrans aktivitet.
- (H2O) = vattnets aktivitet (1).
Då vattnets aktivitet vanligtvis kan sättas till 1, kan ekvationen skrivas om till:
som i sin tur kan skrivas om till:
vilket kan sammanfattas till: