Kolsyra
Från Rilpedia
| Kolsyra | |
|---|---|
  |
|
| Systematiskt namn | Divätekarbonat |
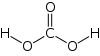
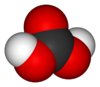
| Kemisk formel | H2CO3 |
| Molmassa | 62,03 g/mol |
| CAS-nummer | 463-79-6 |
| SMILES | C(=O)(O)O |
| SI-enheter & STP används om ej annat angivits | |

Kolsyra (latinskt namn; Acidum carbonicum), H2CO3, är en kemisk förening som bildas i en vattenlösning av koldioxid. Kolsyra är en mycket svag syra som inte kan koncentreras, då koldioxid avges då vattenhalten blir för låg. Kolsyra är populärt att använda vid tillverkning av läskedrycker och uppkommer då socker jäses i en syrefattig miljö, exempelvis öl, cider, mjöd och mousserande vin.
Innehåll |
Jämvikter
I vattenlösning är kolsyra i kemisk jämvikt med löst koldioxid, som i sin tur är i jämvikt med koldioxid i gasform. De bubblor man ser i kolsyrade drycker innehåller alltså i själva verket koldioxid. Eftersom kolsyra är en syra kan den också lämna ifrån sig en eller två positivt laddade vätejoner. Den negativt laddade jonen HCO3– kallas vätekarbonatjon och jonen CO32– kallas karbonatjon. Både vätekarbonat och karbonat är komplexa joner. Hur mycket av jonerna som bildas beror bland annat på lösningens pH – ju högre pH (det vill säga ju lägre koncentration av vätejoner), desto mer benägen är kolsyran att lämna ifrån sig vätejoner.
De jämvikter som koldioxid, kolsyra och dess joner deltar i i vattenlösning kan skrivas:
- CO2(g) Fil:Leftrightarrow.gif CO2(aq)
- Koldioxid i gasfas Fil:Leftrightarrow.gif Koldioxid löst i vatten
- CO2(aq) + H2O Fil:Leftrightarrow.gif H2CO3(aq)
- Koldioxid löst i vatten + vatten Fil:Leftrightarrow.gif Kolsyra
- H2CO3(aq) Fil:Leftrightarrow.gif HCO3–(aq) + H+
- Kolsyra Fil:Leftrightarrow.gif Vätekarbonatjon + vätejon
- HCO3–(aq) Fil:Leftrightarrow.gif CO32–(aq) + H+
- Vätekarbonatjon Fil:Leftrightarrow.gif Karbonatjon + vätejon
Salter av kolsyra
Kolsyra reagerar med reaktiva metaller, främst alkalimetaller och alkaliska jordartsmetaller, under bildning av salter som kallas vätekarbonater och karbonater. Vätekarbonaterna innehåller vätekarbonatjonen HCO3–; karbonaterna innehåller karbonatjonen CO32–.



