Ununoctium
Från Rilpedia
|
|||||||||||||
| Allmänt | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Namn, kemiskt tecken, nummer | ununoctium, Uuo, 118 | ||||||||||||
| Ämnesklass | ädelgaser | ||||||||||||
| Grupp, period, block | 18, 7, p | ||||||||||||
| Densitet | (förutsagd) 13,65[1] kg/m3 (273 K) | ||||||||||||
| Utseende | Okänt, förmodligen färglös[2] | ||||||||||||
| Atomens egenskaper | |||||||||||||
| Atommassa | (294) u | ||||||||||||
| Atomradie (beräknad) | (förutsagd) 152[1] pm | ||||||||||||
| Kovalent radie | (uppskattad) 230 pm | ||||||||||||
| Elektronkonfiguration | [Rn] 7s2 5f14 6d10 7p6[3] | ||||||||||||
| e− per skal | 2, 8, 18, 32, 32, 18, 8[3] | ||||||||||||
| Oxidationstillstånd (oxid) | 0[4], +2[5], +4[5] | ||||||||||||
| Ämnets fysiska egenskaper | |||||||||||||
| Aggregationstillstånd | Vätska (eller fast – förutsagd[3]) | ||||||||||||
| Kokpunkt | (uppskattad) 320–380 K[3] (50–110°C) | ||||||||||||
| Ångbildningsvärme | (förutsagd) 19,4[6] kJ/mol | ||||||||||||
| Smältvärme | (förutsagd) 23,5[6] kJ/mol | ||||||||||||
| Diverse | |||||||||||||
| 1a jonisationspotential | (beräknad) 820–1130[3] kJ/mol | ||||||||||||
| 2a jonisationspotential | (förutsagd) 1450[7] kJ/mol | ||||||||||||
| Mest stabila isotoper | |||||||||||||
|
|||||||||||||
| SI-enheter & STP används om ej annat angivits | |||||||||||||
Ununoctium, eller grundämne 118, är det tillfälliga IUPAC-namnet[9] för det transaktinoida grundämnet med atomnummer 118 och den tillfälliga kemiska beteckningen Uuo. I det periodiska systemet tillhör grundämnet p-blocket och det är även det sista grundämnet i period 7. Ununoctium är för närvarande den enda syntetiska ädelgasen och har det högsta atomnumret och den största atommassan som hittills tillskrivits ett grundämne.
Den radioaktiva ununoctiumatomen är väldigt instabil, och sedan 2002 har man endast lyckats verifiera tre atomer av isotopen 294Uuo.[10] Detta har inneburit att man experimentellt inte lyckats fastställa många av ämnets egenskaper och dess föreningar, teoretiska beräkningar har dock gett upphov till många uppskattningar, varav några oväntade. Exempelvis så kan ununoctium, trots att det är en ädelgas, ha högre reaktivitet än några grundämnen utanför gruppen.[3] Vidare så förmodas grundämnet inte ens vara en gas under normala förhållanden[3][11]
Innehåll |
Historia
Misslyckat försök
Mot slutet av 1998 publicerade den polska fysikern Robert Smolanczuk vissa beräkningar på sammanslagningar av atomkärnor som kunde leda till syntesen av transuraner, däribland grundämne 118.[12] Hans beräkningar antydde att det kunde vara möjligt att skapa grundämne 118 genom att slå samman bly och krypton under noga kontrollerade förhållanden.[12]
1999 använde sig en grupp forskare vid Lawrence Berkeley National Laboratory i USA dessa beräkningar och tillkännagav upptäckten av grundämnena 116 och 118 i Physical Review Letters[13] och strax därefter även i Science[14] Forskarna påstod sig ha genomfört den kemiska reaktionen:
Året därpå drog forskarna tillbaka sin upptäckt då andra inte fick samma resultat då de upprepade försöken.[15] I juni 2002, meddelade labbet att den ursprungliga upptäckten av dessa två grundämnen hade baserats på data som fabricerats av huvudförfattaren Victor Ninov.[16]
Upptäckt
Den 9 oktober 2006, meddelade forskare vid Joint Institute for Nuclear Research (JINR) och Lawrence Livermore National Laboratory i Kalifornien, USA, som arbetade vid JINR i Dubna, Ryssland i Physical Review C[8] att de indirekt hade upptäckt totalt tre kärnor av isotopen ununoctium-294 (en 2002[17] och ytterligare två 2005) vid kollisionen mellan californiumatomer och kalciumjoner:[18][19][20][21][22]
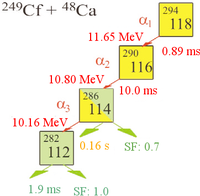
På grund av att den lilla sannolikheten för en fusionreaktion (fusionens tvärsnitt är endast 0,5 pikobarn = 5*10−41 m2) tog experimentet 4 månader och innefattade en stråldos på 4*1019 kalciumjoner som sköts på californiummåltavlan för att skapa den första registrerade händelsen som tros vara syntesen av ununoctium.[2] Emellertid är forskarna starkt övertygade om att resultaten inte är ett falskt positivt, eftersom sannolikheten att upptäckterna var slumpmässiga händelser uppskattas vara mindre än en på 100 000.[23]
I experimenten observerades tre atomer av ununoctium. En halveringstid på 0,89 ms beräknades: 294Uuo sönderfaller till 290Uuh genom alfasönderfall. Eftersom det endast fanns tre kärnor är den uppskattade halveringstiden bestämd med stor osäkerhet: 0,89+1,07-0,31 ms.[8]
- 294Uuo → 290Uuh + 4He
Upptäckten av 294Uuo-kärnan bekräftades genom att man separat även skapade den antagna dotterkärnan 290Uuh genom att bombardera 245Cm med 48Ca-joner
- 245Cm + 48Ca → 290Uuh + 3 n
och se att sönderfallskedjan hos 290Uuh gick ihop med den hos 294Uuo-kärnan.[8] Dotterkärnan 290Uuh är väldigt instabil och sönderfaller med en halveringstid på 14 millisekunder till 286Uuq, vilken kan genomgå spontan fission eller alfasönderfall till 282Uub, som genomgår spontan fission.[8]
Efter att ha lyckats framställa ununoctium har upptäckarna påbörjat liknande experiment i hopp om att kunna skapa grundämne 120 (unbinilium) från 58Fe och 244Pu[24] Isotoperna hos grundämne 120 förutspås ha en halveringstid på någon mikrosekund och likt Ununoctium utsöndra alfastrålning.[25][26]
Benämning
Grundämne 118 fick sitt nuvarande namn 1979 då IUPAC publicerade de rekommendationer om hur nya grundämnen ska namnges som gav upphov till namnet ununoctium.[27] Namnet ununoctium är ett systematiskt grundämnesnamn som fungerar som ställföreträdare tills andra forskargrupper lyckas bekräfta grundämnet och IUPAC beslutar om ett nytt namn.
Innan den första upptäckten drogs tillbaka 2002 avsåg forskare från Berkeley att ge grundämnet namnet ghiorsium (Gh), efter Albert Ghiorso (en ledande medlem av forskarteamet).[28] Några år senare, då de ryska upptäckarna meddelade sin syntes 2006, spred sig rykten om att de planerade att uppkalla grundämnet efter den plats där det upptäcktes, dubnadium (Dn) (väldigt likt det 105:e grundämnet, dubnium (Db)).[29] Emellertid meddelade chefen för det ryska institutet, under en intervju med en rysk tidning, att forskarlaget övervägde två namn för det nya grundämnet, Flyorium för att hedra Georgy Flyorov, grundare av forskningsinstitutionen; och moskovium (även stavat moscovium eller till och med moscowium), efter Moskva oblast, i vilken Dubna ligger.[30] Han meddelade även att, trots att grundämnet upptäcktes som ett amerikanskt samarbete, som skaffade californiummålet, så skulle grundämnet rätteligen namnges med heder åt Ryssland eftersom Flerov Laboratory of Nuclear Reactions vid JINR är den enda anläggningen i världen som skulle kunna åstadkomma dessa resultat.[31][32]
Kännetecken
Kärnstabilitet och isotoper
Det finns inga grundämnen med ett atomnummer över 82 (efter bly) som har stabila isotoper. Kärnans stabilitet minskar då atomnumret stiger. Alla isotoper med ett atomnummer över 101 sönderfaller radioaktivt med en halveringstid under en dag. På grund av anledningar man ännu inte har förstått helt så finns det en viss ökning i kärnstabiliteten kring atomnummer 110-114, vilket leder till ett utseende som inom kärnfysiken är känt som "stabilitetsön". Detta koncept, som föreslogs av UC Berkeley-professorn Glenn Seaborg, förklarar varför transuranerna har en längre halveringstid än förväntat.[33] Ununoctium är radioaktivt och har en halveringstid som verkar ligga under en millisekund. Detta är dock längre än några förutspådda värden,[34][35] vilket har gett vidare stöd för teorin om en "stabilitetsö".[36].
Tunneleffektsmodellen förutspår att ett flertal neutronrika isotoper till grundämne 118 finns, och att dessa sönderfaller genom alfasönderfall med halveringstider nära en millisekund.[25][37]
Teoretiska beräkningar på de syntetiska sönderfallskedjorna, och halveringstiden för andra isotper har visat att några kan var något mer stabila än den syntetiserade isotopen 294Uuo, exempelvis 293Uuo, 295Uuo, 296Uuo, 297Uuo, 298Uuo, 300Uuo och 302Uuo.[34][38] Av dessa antas 297Uuo ha störst chans att få en något mer långlivad kärna,[34][38] och således kan just den isotopen bli målet för framtida studier av ununoctium. Vissa isotoper med ännu fler neutroner, som exempelvis isotoper kring 313Uuo, kan också ge mer stabila kärnor.[39]
Egenskaper
Ununoctium tillhör den grupp grundämnen som saknar valenselektroner, de så kallade ädelgaserna. På grund av detta antas ununoctium ha kemiska och fysiska egenskaper liknande de hos övriga ädelgaser, och då särskilt den närmaste ädelgasen i det periodiska systemet, radon.[40] Medlemmarna i den här gruppen är extremt motståndskraftiga mot kemiska reaktioner (som exempelvis förbränning) på grund av att det valensskalet är helt fyllt med åtta elektroner. Detta ger en stabil sammansättning med låg energi där de yttre elektronerna är starkt sammankopplade.[41] Man tror därför att även ununoctium har ett stängt yttre valensskal i vilket dess valenselektroner är ordnade i konfigurationerna 7s2, 7p6.[3]

Utifrån de periodiska trenderna borde det antas att ununoctium är något mer reaktivt än radon, och teoretiska beräkningar har visat att grundämnet kan vara väldigt reaktivt med tanke på dess "ädla" status.[5] Förutom att vara betydligt mer reaktiv än radon kan ununoctium till och med vara mer reaktiv än grundämnena 114 och 112.[3] Denna uppenbara skillnad i reaktivitet hos ununoctium relativt till radon beror på destabiliseringen i energin och den radiala utvidgningen hos det senast fyllda underskalet 7p.[3][42] Mer exakt beror detta på ett flertal växelverkningar i elektronernas spinn och rörelse mellan 7p-elektronerna och de trögreaktiva 7s2-elektronerna, vilket leder till en andra valensskalsstängning vid grundämne 114, och en avsevärd minskning i stabilitet hos det stängda skalet hos ununoctium.[3] Man har också beräknat att ununoctium, till skillnad mot övriga ädelgaser, avger energi då den binder till en elektron, alltså påvisar grundämnet positiv elektronaffinitet.[43][44]
Ununoctium förväntas ha den bredaste polariserbarheten av alla grundämnen före sig i det periodiska systemet, och nästan dubbelt så stor som radons.[3] Genom att studera de andra ädelgaserna har man förutspått att ununoctium har en kokpunkt mellan 320 och 380 K. [3] Detta skiljer sig väldigt från tidigare uppskattningar på 263 K[7] eller 247 K.[45] Trots att testernas resultat är väldigt osäkra så är det väldigt otroligt att grundämne 118 är en gas under standardtryck och -temperatur.[3][11] Och eftersom temperaturspannet för vätskefasen hos övriga ädelgaser är väldigt smalt, mellan 2 och 9 kelvin, bör det här grundämnet vara fast vid standardförhållanden. På grund av dess oerhörda polariserbarhet förväntas ununoctium ha en onormalt låg jonisationspotential (liknande den hos bly som i sin tur är 70% av den hos radon [46] och betydligt mindre än den hos grundämne 114[47]) och ett standard kondenserat tillstånd.[3] Emellertid, även om ununoctium är en monatomisk gas under standardförhållanden, skulle det vara en av de ämnen i gasform med högst molekylmassa, endast UF6 med en molekylmassa på 352 u skulle slå den.
Föreningar och användningsområden

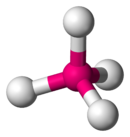
Ännu har inga föreningar med ununoctium syntetiserats, men beräkningar för teoretiska föreningar har genomförts redan 1964.[48] Det antas att om jonisationspotentialen hos ämnet är tillräckligt högt, så kommer det vara väldigt svårt att oxidera och därför kommer det vanligaste oxidationstillståndet att vara 0 (likt övriga ädelgaser).[4]
Bindningen mellan ununoctium och väte i UuoH är väldig svag och kan betraktas som ett rent van der Waals-samspel snarare än en äkta kemisk bindning.[46] Å andra sidan verkar det som om ununoctium bildar stabilare föreningar med starkt elektronegativa ämnen än vad grundämne 112 och 114 gör.[46] De stabila oxidationstillstånden +2 och +4 har förutspåtts finnas i de fluorinerade föreningarna UuoF2 och UuoF4.[49] Detta är ett resultat av samma växelverkningar i elektronernas spinn och rörelse som gör ununoctium ovanligt reaktiv. Det har till exempel visats att reaktionen mellan Uuo och F2, som bildar föreningen UuoF2, skulle avge en energi på 106 kcal/mol, av vilket 46 kcal/mol kommer från dessa växelverkningar.[46] Som jämförelse är växelverkningar i elektronernas spinn och rörelse hos den liknande molekylen RnF2 cirka 10 kcal/mol av den totala bildningsenergin på 49 kcal/mol.[46] Samma växelverkan stabiliserar den tetraedriska Td-konfigurationen för UuoF4, till skillnad från den plankvadratiska D4h-konfigurationen hos XeF4 och RnF4.[49] Bindningen Uuo-F kommer troligtvis att vara en jonbindning snarare än en kovalent bindning, vilket betyder att UuoFn-föreningarna troligtvis kommer att vara i fast eller flytande form.[5][50] Till skillnad mot de övriga ädelgaserna antas ununoctium vara tillräckligt elektropositiv för att kunna bilda Uuo-Cl-bindningar med klor.[5]
Eftersom man hittills endast lyckats skapa tre atomer av ununoctium så finns det än så länge inga användningsområden utanför den grundläggande vetenskapliga forskningen. Grundämnet skulle utgöra en strålningsrisk om tillräckligt mycket skapades på en och samma plats.[51]
Referenser
Källor
- Artikeln är, helt eller delvis, en översättning från engelskspråkiga Wikipedia.
Noter
- ↑ 1,0 1,1 ”Moskowium”. Apsidium. http://www.apsidium.com/elements/118.htm. Läst 2008-01-18.
- ↑ 2,0 2,1 ”Ununoctium”. WebElements Periodic Table. http://webelements.com/webelements/elements/text/Uuo/key.html. Läst 2008-01-18.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 Clinton S. Nash, Atomic and Molecular Properties of Elements 112, 114, and 118 (2005) J. Phys. Chem. A. 109. (15).sid. 3493–3500. På internet 2008-01-18.
- ↑ 4,0 4,1 ”Ununoctium: Binary Compounds”. WebElements Periodic Table. http://webelements.com/webelements/elements/text/Uuo/comp.html. Läst 2008-01-18.
- ↑ 5,0 5,1 5,2 5,3 5,4 Uzi Kaldor, Stephen Wilson: Theoretical Chemistry and Physics of Heavy and Superheavy Elements, Springer, 2003, sid. 105. ISBN 140201371X. Hämtat 2008-01-18.
- ↑ 6,0 6,1 R. Eichler, B. Eichler. ”Thermochemical Properties of the Elements Rn, 112, 114, and 118”. Paul Scherrer Institut. http://lch.web.psi.ch/pdf/anrep03/06.pdf. Läst 2008-01-18.
- ↑ 7,0 7,1 Glenn Theodore Seaborg: Modern Alchemy, World Scientific, 1994. ISBN 9810214405. Hämtat 2008-01-18.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 Oganessian, Yu. Ts., Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm + 48Ca fusion reactions Physical Review C. 74. (4).sid. 044602. På internet 2008-01-18. . DOI:10.1103/PhysRevC.74.044602
- ↑ M.E. Wieser, Atomic weights of the elements 2005 (IUPAC Technical Report) (2006) 78. (11).sid. 2051–2066. På internet 2008-01-18. . DOI:10.1351/pac200678112051
- ↑ ”The Top 6 Physics Stories of 2006”. Discover Magazine. 2007-01-07. http://discovermagazine.com/2007/jan/physics/article_view?b_start:int=1&-C=. Läst 2008-01-18.
- ↑ 11,0 11,1 Det är omdebatterat huruvida gruppen 'ädelgaser' kommer att byta namn om ununoctium visar sig vara i fast eller flytande form.
- ↑ 12,0 12,1 Robert Smolanczuk, Production mechanism of superheavy nuclei in cold fusion reactions (1999) Physical Review C. 59. (5).sid. 2634–2639. På internet 2008-01-18.
- ↑ Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb Physical Review Letters. 83. (6–9).sid. 1104–1107. På internet 2008-01-18. . DOI:10.1103/PhysRevLett.83.1104
- ↑ Robert F. Service, Berkeley Crew Bags Element 118 Science. 284. sid. 1751. På internet 2008-01-18. . DOI:10.1126/science.284.5421.1751
- ↑ Public Affairs Department (2001-07-21). ”Results of element 118 experiment retracted”. Berkeley Lab. http://enews.lbl.gov/Science-Articles/Archive/118-retraction.html. Läst 2008-01-18.
- ↑ Misconduct: The stars who fell to Earth Nature. 420. sid. 728–729. . DOI:10.1038/420728a
- ↑ Oganessian Yu.Ts. et al. (2002). ”Element 118: results from the first 249Cf + 48Ca experiment”. Communication of the Joint Institute for Nuclear Research. http://159.93.28.88/linkc/118/anno.html. Läst 2008-01-18.
- ↑ ”Livermore scientists team with Russia to discover element 118”. Livermore press release. 2006-12-03. https://publicaffairs.llnl.gov/news/news_releases/2006/NR-06-10-03.html. Läst 2008-01-18.
- ↑ Yu. Ts. Oganessian, Synthesis and decay properties of superheavy elements Pure Appl. Chem.. 78. sid. 889–904. . DOI:10.1351/pac200678050889
- ↑ ”Heaviest element made - again”. Nature. 2006-10-17. http://www.nature.com/news/2006/061016/full/061016-4.html. Läst 2008-01-18.
- ↑ Phil Schewe; Ben Stein (2006-10-17). ”Elements 116 and 118 Are Discovered”. American Institute of Physics. http://www.aip.org/pnu/2006/797.html. Läst 2008-01-18.
- ↑ Rick Weiss (2006-10-17). ”Scientists Announce Creation of Atomic Element, the Heaviest Yet”. Washington Post. http://www.washingtonpost.com/wp-dyn/content/article/2006/10/16/AR2006101601083.html. Läst 2008-01-18.
- ↑ ”Element 118 Detected, With Confidence”. Chemical and Engineering news. 2006-10-17. http://pubs.acs.org/cen/news/84/i43/8443element118.html. Läst 2008-01-18. ”"I would say we're very confident."”
- ↑ ”A New Block on the Periodic Table”. Lawrence Livermore National Laboratory. april 2007. https://www.llnl.gov/str/April07/pdfs/04_07.4.pdf. Läst 2008-01-18.
- ↑ 25,0 25,1 P. Roy Chowdhury, C. Samanta, och D. N. Basu, Search for long lived heaviest nuclei beyond the valley of stability (2008) Phys. Rev. C. 77. sid. 044603.
- ↑ P. Roy Chowdhury, C. Samanta, och D. N. Basu, Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130 (2008) At. Data & Nucl. Data Tables.
- ↑ J. Chatt, Recommendations for the Naming of Elements of Atomic Numbers Greater than 100 (1979) Pure Appl. Chem.. 51. sid. 381–384. På internet 2008-01-18.
- ↑ ”Discovery of New Elements Makes Front Page News”. Berkeley Lab Research Review Summer 1999. 1999. http://lbl.gov/Science-Articles/Research-Review/Magazine/1999/departments/breaking_news.shtml. Läst 2008-01-18.
- ↑ D. Trapp. ”Origins of the Element Names-Names Constructed from other Words”. http://homepage.mac.com/dtrapp/Elements/combination2.html#116. Läst 2008-01-18.
- ↑ ”New chemical elements discovered in Russia's Science City”. 2007-02-12. http://news.rin.ru/eng/news/9886/9/6/. Läst 2008-02-09.
- ↑ NewsInfo (2006-10-17). ”Periodic table has expanded”. Rambler. http://www.rambler.ru/news/science/0/8914394.html. Läst 2008-01-18.
- ↑ ”118th element will be named in Russian”. vesti.ru. 2006-12-17. http://www.vesti.ru/doc.html?id=113947. Läst 2008-01-18.
- ↑ Glenn D Considine; Peter H Kulik: Van Nostrand's scientific encyclopedia, Wiley-Interscience, 2002, 9. ISBN 9780471332305.
- ↑ 34,0 34,1 34,2 P. Roy Chowdhury, C. Samanta, och D. N. Basu, α decay half-lives of new superheavy elements (2006) Phys. Rev. C. 73. sid. 014612. På internet 2008-01-18.
- ↑ Yuri Oganessian, Heaviest nuclei from 48Ca-induced reactions (2007) J. Phys. G: Nucl. Part. Phys.. 34. sid. R165–R242. På internet 2008-01-18. . DOI:10.1088/0954-3899/34/4/R01
- ↑ ”New Element Isolated Only Briefly”. The Daily Californian. 2006-10-18. http://www.dailycal.org/printable.php?id=21871. Läst 2008-01-18.
- ↑ P. Roy Chowdhury, C. Samanta, och D. N. Basu, Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130 (2008) At. Data & Nucl. Data Tables.
- ↑ 38,0 38,1 G. Royer, K. Zbiri, C. Bonilla, Entrance channels and alpha decay half-lives of the heaviest elements (2004) Nuclear Physics A. 730. sid. 355–376. På internet 2008-01-18. . DOI:doi:10.1016/j.nuclphysa.2003.11.010
- ↑ S B Duarte, O A P Tavares, M Gonçalves, O Rodríguez, F Guzmán, T N Barbosa, F García och A Dimarco, Half-life predictions for decay modes of superheavy nuclei (2004) J. Phys. G: Nucl. Part. Phys.. 30. sid. 1487–1494. På internet 2008-01-18. . DOI:10.1088/0954-3899/30/10/014
- ↑ ”Ununoctium (Uuo) - Chemical properties, Health and Environmental effects”. Lenntech. http://lenntech.com/Periodic-chart-elements/Uuo-en.htm. Läst 2008-01-18.
- ↑ Bader, Richard F.W.. ”An Introduction to the Electronic Structure of Atoms and Molecules”. McMaster University. http://miranda.chemistry.mcmaster.ca/esam/. Läst 2008-01-18.
- ↑ Det faktiska citatet är: "The reason for the apparent enhancement of chemical activity of element 118 relative to radon is the energetic destabilization and radial expansion of its occupied 7p3/2 spinor shell"
- ↑ Igor Goidenko, Leonti Labzowsky, Ephraim Eliav, Uzi Kaldor, och Pekka Pyykko, QED corrections to the binding energy of the eka-radon (Z=118) negative ion (2003) Physical Review A. 67. På internet 2008-01-18.
- ↑ Ephraim Eliav och Uzi Kaldor, Element 118: The First Rare Gas with an Electron Affinity Physical Review Letters. 77. (27). På internet 2008-01-18.
- ↑ N. Takahashi, Boiling points of the superheavy elements 117 and 118 (2002) Journal of Radioanalytical and Nuclear Chemistry. 251. (2).sid. 299–301. På internet 2008-01-18.
- ↑ 46,0 46,1 46,2 46,3 46,4 Young-Kyu Han, Cheolbeom Bae, Sang-Kil Son, och Yoon Sup Lee, Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118) Journal of Chemical Physics. 112. (6). På internet 2008-01-18.
- ↑ Clinton S. Nash, Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118 (1999) J. Phys. Chem. A. 103. (3).sid. 402–410. På internet 2008-01-18.
- ↑ A. V. Grosse, Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em) (1965) Journal of Inorganic and Nuclear Chemistry. 27. (3).sid. 509–19. . DOI:10.1016/0022-1902(65)80255-X
- ↑ 49,0 49,1 Young-Kyu Han och Yoon Sup Lee, Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4 J. Phys. Chem. A. 103. (8).sid. 1104–1108. På internet 2008-01-18.
- ↑ Kenneth S. Pitzer, Fluorides of radon and element 118 (1975) J. Chem. Soc., Chem. Commun.. sid. 760b–761. . DOI:10.1039/C3975000760b
- ↑ ”Ununoctium: Biological information”. WebElements Periodic Table. http://webelements.com/webelements/elements/text/Uuo/biol.html. Läst 2008-01-18.
Se även
- Wikimedia Commons har media som rör Ununoctium
- Transuraner
- Ununhexium
| Företrädare: Ununseptium |
Grundämnen i period 7 Ununoctium |
Efterträdare: (Ununennium) |
| Företrädare: Radon |
Ädelgaser Ununoctium |
Efterträdare: (Unhexoctium) |
Externa länkar
- ELEMENT 118: EXPERIMENTS on DISCOVERY, arkiv på upptäckarnas officiella hemsida
- Chemistry-Blog: Oberoende analys om anspråket på grundämne 118
- WebElements: Ununoctium
- Apsidium: Ununoctium - Moskowium
- It's Elemental: Ununoctium
- Angående anspråk på upptäckten av grundämnena 110, 111, 112, 114, 116 och 118 (IUPAC Technical Report)