Nitroglycerin
Från Rilpedia
| Nitroglycerin | |
|---|---|
 |
|
| Systematiskt namn | Propyl-1,2,3-trinitrat |
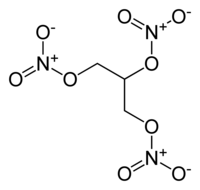
| Kemisk formel | C3H5(ONO2)3 |
| Molmassa | 227,0872 g/mol |
| Utseende | Gul, aningen oljig vätska, men färglös och transparent när den är ren |
| CAS-nummer | 55-63-0 |
| Egenskaper | |
| Densitet | 1,13 g/cm³ |
| Smältpunkt | 13,2 °C |
| SI-enheter & STP används om ej annat angivits | |
Nitroglycerin (glyceryltrinitrat, propyl-1,2,3-trinitrat, C3H5(ONO2)3 är en i rent tillstånd färglös, oljig och mycket explosiv kemikalie. Nitroglycerin är en ester bildad av salpetersyra och glycerol. Kommersiellt framställs det genom att behandla glycerol med salpetersyra och svavelsyra.
Nitroglycerin används vid tillverkning av sprängämnen, speciellt dynamit. Det är extremt explosivt, och redan vid tillverkningen finns risk för en detonation, om till exempel tillräcklig kylning ej erhålles. I sin rena form är nitroglycerin ytterst stötkänsligt, till exempel kan en fysisk stöt få den att explodera. Nitroglycerin har dålig hållbarhet och sönderfaller snart till ännu mer instabila former. Detta gör nitroglycerin mycket farlig att transportera eller använda i dess rena form. Nitroglycerin blir gult när det sönderdelas.
Den förste som lyckades göra en sprängmedelsblandning innehållande nitroglycerin med avsevärt mindre risk för ofrivillig detonation var Alfred Nobel. Alfred Nobel blandade i kiselgur för att nitroglycerinet skulle bli fast.
Innehåll |
Historia
Nitroglycerin framställdes första gången år 1847 av den italienska kemisten Ascanio Sobrero. Det innehåller kväve och syre i nästan exakta proportioner för förbränning till NOx gaser vilket leder till en extremt snabb tryckökning vilket leder till fulfärdad detonation.
Egenskaper
Nitroglycerin innehåller 15,87 vikt-% kol, 2,22 vikt-% väte, 18,50 vikt-% kväve och 63,41 vikt-% syre och binds med opolära kovalenta bindningar.
Tidigt i historien av detta explosiva ämne så upptäcktes det att flytande nitroglycerin kan bli desensitiserat genom nedkylning till 5 - 10 °C, där det stelnar (fryspunkten är +13 °C. Men det kan senare vid upptining bli extremt känsligt, speciellt om uppvärmningen är för hastig. Det är möjligt att kemiskt desensitisera nitroglycerin till en punkt där det kan ses som nästan helt säkert. Desensitisation kräver extra arbete att späda ut nitroglycerinet till dess ursprungliga konsistens, den ”rena” produkten. Om detta misslyckas förmodar man att desensitiserat nitroglycerin är substansmässigt svårare att detonera, vilket antagligen gör det oanvändbart som explosivt ämne för praktisk användning.
Användningsområden
Användning som sprängämne
När nitroglycerin detonerar sönderdelas det till många små gasmolekyler. I det sönderfallet produceras 4 mol C3H5(ONO2) och 29 mol olika gasmolekyler. Det är tryckvågen från den plötsliga volymökningen som man uppfattar som en explosion.
En explosion är en mycket snabb förbränning, och den kräver bränsle och en oxidant. I det perfekta sprängmedlet råder det jämvikt mellan bränsle och syre. Men för de flesta sprängmedel gäller att det inte råder jämvikt, utan det är ett litet överskott av någon komponent. Nitroglycerin innehåller båda komponenterna. Om den detoneras under högt tryck exploderar den och bildar gas av tusen gånger dess ursprungliga volym. En av dessa gaser är kvävgas. N2 är mycket stabil, så dess produktion är mycket exoterm, vilket förklarar varför kväve är en vanlig komponent i sprängämnen.
Nitroglycerinets stora fördel (förutom att det är ett kraftigt sprängämne) är att det inte bildar några fasta former av kol (till exempel aska eller sot) vid detonationen. Denna fördel kan man utnyttja genom att tillverka "rökfritt krut". Detta är praktiskt i militära tillämpningar där soldater, kanonskyttar etc slipper få synfältet skymt av krutrök. Krutrök avslöjar också skjutplatsen och blir ledfyr för artilleribekämpning.
Nitroglycerin finns i både civila och militära krut.
Medicinsk användning
Inom medicin används nitroglycerin som behandling mot kärlkramp, så kallad angina pectoris, och akut lungödem. Nitroglycerin ombildas i kroppen till kvävemonoxid. Kväveoxidfrisättningen gör att blodkärlen vidgar sig så att hjärtarbetet minskas och mer syrerikt blod når hjärtat; då minskar syrebristen och smärtorna avtar. Medicinen finns som tablett, spray och läkemedel för intravenöst bruk. Det säljs under namn som Nitroglycerin, Nitromex, Nitrolingual och Suscard.
Framställning
Den industriella produktionsprocessen använder en blandning med proportionerna 50:50 av högt koncentrerad svavelsyra och högt koncentrerad salpetersyra. Detta skapar nitroniumjoner som blir attackerade av glycerinets nukleofila syreatomer. Nitrogruppen NO2 blir då adderad.
Användning av starka syror resulterar nästan alltid i en exoterm reaktion (d v s värme är produceras), och denna reaktion är inget undantag. Om blandningen blir för varm kan den explodera. Syrablandningen tillsätts långsamt ett reaktionskärlet innehållande glycerin. Reaktionskärlet hålles nerkylt till ungefär 0 °C. Kärlet har en nödöppningsdörr på botten och därunder finns en stor bassäng med kallt vatten. Om sensorerna i blandingen upptäcker att temperaturen höjs för snabbt, så kan hela blandningen släppas ut i isvattnet som förhindrar en möjlig explosion.



