Etenoxid
Från Rilpedia
| Etenoxid | |
|---|---|
  |
|
| Systematiskt namn | Epoxietan |
| Övriga namn | Etylenoxid, oxiran |
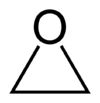
| Kemisk formel | C2H4O |
| Molmassa | 44,05 g/mol |
| Utseende | färglös gas |
| CAS-nummer | 75-21-8 |
| SMILES | C1CO1 |
| Egenskaper | |
| Densitet | 0,882 g/cm³ |
| Löslighet (vatten) | Löslig |
| Smältpunkt | −111,3 °C |
| Kokpunkt | 10,7 °C |
| SI-enheter & STP används om ej annat angivits | |
Etenoxid, etylenoxid eller oxiran är en viktig industrikemikalie som används i tillverkningen av etandiol (glykol) och andra kemikalier, och som steriliseringsmedel för livsmedel och medicinsk utrustning. Ämnet är en färglös brandfarlig gas med svagt sötaktig lukt. Kemiskt är det den enklaste epoxiden.
Innehåll |
Historia
Etenoxid framställdes för första gången 1859 av den franska kemisten Charles-Adolphe Wurtz, som framställde det genom att behandla 2-kloretanol med en bas. Ämnet fick betydelse för industrin under första världskriget som råvara för både kylmedlet glykol och stridsgasen senapsgas. Theodore Lefort, en annan fransk kemist, upptäckte 1931 ett sätt att framställa etenoxid direkt ur eten (H2C=CH2) och syre (O2), med silver som katalysator. Sedan 1940 har nästan all industriellt producerad etenoxid framställts med denna metod. Reaktionen sker vid 200–300 °C och 1–2 MPa, och ger ett utbyte på 70–80 %.
Användningsområden
Etenoxid dödar bakterier (och deras endosporer), mögel och svampar, och kan därför användas för att sterilisera substanser som skulle skadas av värme (pastörisering). Etenoxidsterilisering för konservering av kryddor patenterades 1938 av den amerikanska kemisten Lloyd Hall, och används fortfarande. Etenoxid används också i stor utsträckning för att sterilisera medicinsk utrustning, såsom bandage, suturer och kirurgiska redskap.
Huvuddelen av all etenoxid används dock för att tillverka andra kemikalier. Det viktigaste användningsområdet är produktion av etandiol, som sedan används i polyestertillverkning och som frostskyddsmedel.
Reaktioner
De flesta reaktionerna är nukleofila ringöppningar.
I industrin får etenoxid reagera med vatten, med svavelsyra som katalysator. Substansmängden vatten bör vara cirka tio gånger så stor som substansmängden etenoxid:
- C2H4O + H2O → HOCH2CH2OH
Trots det stora överskottet av vatten kommer olika sorters polyetylenglykoler att bildas som biprodukter. Polymerisationsgraden ökar med minskande mängd vatten.
Om vattnet byts ut mot ammoniak blir produkterna etanolamin, dietanolamin eller trietanolamin.
Etenoxid används också i tillverkning av tensider och andra rengöringsmedel, i en process som kallas etoxilering.
Hälsorisker
Etenoxid är giftig vid inandning. Bland symptomen finns huvudvärk och yrsel, som vid ökad exponering förvärras till konvulsioner och koma. Ämnet irriterar också huden och andningsapparaten, och inandning kan göra att lungorna vätskefylls flera timmar senare.
Etenoxid förvaras vanligtvis i vätskeform, nedkyld och under tryck. Vid rumstemperatur och atmosfärstryck avdunstar det snabbt, vilket kan leda till köldskador om man får flytande etenoxid på sig.
Artikelursprung
- Artikeln är, helt eller delvis, en översättning från engelskspråkiga Wikipedia.



