Kobolt
Från Rilpedia
Version från den 5 maj 2009 kl. 00.28 av RibotBOT (Diskussion)
|
|||||||||||||||||||||||||||||||||||||
| Allmänt | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
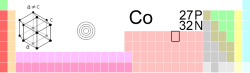
| Namn, kemiskt tecken, nummer | kobolt, Co, 27 | ||||||||||||||||||||||||||||||||||||
| Ämnesklass | övergångsmetaller | ||||||||||||||||||||||||||||||||||||
| Grupp, period, block | 9, 4, d | ||||||||||||||||||||||||||||||||||||
| Densitet | 8900 kg/m3 (273 K) | ||||||||||||||||||||||||||||||||||||
| Hårdhet | 5,0 | ||||||||||||||||||||||||||||||||||||
| Utseende | Gråaktig metall |
||||||||||||||||||||||||||||||||||||
| Atomens egenskaper | |||||||||||||||||||||||||||||||||||||
| Atommassa | 58,933200 u | ||||||||||||||||||||||||||||||||||||
| Atomradie (beräknad) | 135 (152) pm | ||||||||||||||||||||||||||||||||||||
| Kovalent radie | 126 pm | ||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Ar]3d74s2 | ||||||||||||||||||||||||||||||||||||
| e− per skal | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd (oxid) | 3, 2 (amfoterisk) | ||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Hexagonal tätpackning (hcp) | ||||||||||||||||||||||||||||||||||||
| Ämnets fysiska egenskaper | |||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | solid | ||||||||||||||||||||||||||||||||||||
| Smältpunkt | 1768 K (1495 °C) | ||||||||||||||||||||||||||||||||||||
| Kokpunkt | 3200 K (2927 °C) | ||||||||||||||||||||||||||||||||||||
| Molvolym | 6,67 ·10-6 m3/mol | ||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 376,5 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Smältvärme | 16,19 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Ångtryck | 175 Pa vid 1768 K | ||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 4720 m/s vid 293,15 K | ||||||||||||||||||||||||||||||||||||
| Diverse | |||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,88 (Paulingskalan) | ||||||||||||||||||||||||||||||||||||
| Värmekapacitet | 420 J/(kg·K) | ||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsförmåga | 17,2×106 S/m (Ω−1·m−1) | ||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 100 W/(m·K) | ||||||||||||||||||||||||||||||||||||
| 1a jonisationspotential | 760,4 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2a jonisationspotential | 1648 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 3e jonisationspotential | 3232 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 4e jonisationspotential | 4950 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Mest stabila isotoper | |||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
| SI-enheter & STP används om ej annat angivits | |||||||||||||||||||||||||||||||||||||
Kobolt är ett hårt, silvergrått, metalliskt grundämne med kemisk beteckning Co. Kobolt är ferromagnetiskt med en curiepunkt på 1388 K. Kobolt används i metallindustri, och isotopen kobolt 60 har även använts inom medicinsk strålterapi.
Historia
Kobolt har länge använts för att få blå färg på glas och keramik.
Den svenske kemisten Georg Brandt (1694–1768) isolerade kobolt på 1730-talet och visade att kobolt är källan till den blå färgen i glas, som man tidigare trodde kom från vismut. Namnet kobolt kommer från kobold, ett väsen man förr trodde bodde i underjorden och kunde påverkade malmen i gruvor.
Se även
- Periodiska systemet
- Koboltblått
- Blaafarveværket framställde blåfärg ur koboltmalm.