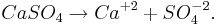Salter
Från Rilpedia
Inom kemin är salter eller jonföreningar jonbundna kemiska föreningar som består av positivt laddade katjoner och negativt laddade anjoner sammansatta så att nettoladdningen blir neutral, det vill säga noll. Exempel är natriumklorid NaCl (koksalt) som består av katjonen Na+ och anjonen Cl- och kalciumfluorid CaF2 som består av katjonen Ca2+ och anjonen F-. I det senare fallet krävs två fluoridjoner per kalciumjon för att nettoladdningen skall bli noll. Jonerna kan:
- bestå av enstaka atomer som fluoridjonen F- eller flera atomer som sulfatjonen SO42-
- vara oorganiska som natriumjonen Na+ och kloridjonen Cl- eller organiska som acetatjonen CH3-COO-
I fast form bygger jonerna upp kristaller i ett strikt mönster. I lösningsmedel dissocierar jonerna, och rör sig mer oberoende av varandra. Således är till exempel kalciumsulfat dissocierat i en kalciumjon (Ca+2) och en sulfatjon (SO4-2):
Lösningar av salt i vatten kallas elektrolyter. Elektrolyter såväl som smälta salter leder elektricitet. Zwitterjoner är salter som i en och samma kovalent bundna molekyl innehåller både ett katjoniskt och anjoniskt center. Exempel är aminosyror och proteiner.
Innehåll |
Bildning
Salt kan bildas på följande olika vis:
- Reaktion mellan en bas och en syra; till exempel NH3 + HCl → NH4Cl
- Reaktion mellan en metall och en syra; till exempel Mg + H2SO4 → MgSO4 + H2
- Blandning av två olika saltlösningar så att jonerna kombineras på nytt sätt och att ett av salterna har låg löslighet och därmed kristalliserar.
- Reaktion mellan en syra och en metalloxid.
Historik
Historiskt har definitionen på salter varierat under kemins utvecklingsskeden. För mycket länge sedan tolkades salt av alkemisterna som alla fasta och oförbrännliga ämnen. Senare började man beteckna salt som kemiska föreningar med snarlika egenskaper som koksalt. Under 1700-talet definierades salter som dess förmåga att lösa sig i vatten, närmare bestämt ett salt är en kropp med förmågan att lösa sig i mindre än 500 delar vatten. I slutet på 1700-talet började de mer moderna definitionerna ta form, och man började skilja mellan syror, alkalier och medelsalter. Visserligen tolkades saltet till en början som en förening mellan två oxider, men undersökningar visade att ex. vätecyanid och saltsyra inte innehöll syre, och vid inverkan med oxider skapas både vatten och salter. 1810 framlades teorin att saltsyrade salter eller så kallade klorider inte innehåller syre utan är föreningar mellan grundämnet klor (Cl) och metaller. Svensken Berzelius framförde 1820 åsikten att salter har olika föreningar samt indelade salter i amfidsalter och haloidsalter. Den tidigare är en förening som kan antingen bestå av två oxider, så kallade syresalter, eller av två sulfider eller så kallade svavelsalter. Haloidsalter är en förening av metall och en saltbildare. Lite senare framlades definitionen att salter är föreningar där vätet (H) i en syra är ersatt med någon annan positiv jon, ofta en metalljon.[1]
Definitionen av ett salt som produkten av en reaktion mellan en syra och en bas omfattar både jonföreningar och en del kovalenta föreningar, bland annat kvicksilverklorid HgCl2, och hör ihop med Arrhenius syra-basdefinition. I och med att Johannes Brønsteds syra-basdefinition vann spridning bland kemister blev salter svårare att definiera, men numera sätts ofta likhetstecken mellan jonförening och salt.[2] [3] I vissa fall undantar man från dagens saltdefinition jonföreningar som innehåller oxoniumjonen H3O+[4] eller jonföreningar som inte bildats genom en reaktion mellan en syra och en bas[5].
Typer av salter
- Klorider – saltsyrans salter
- Sulfater – svavelsyrans salter
- Nitrater – salpetersyrans salter
- Karbonater – kolsyrans salter
- Fosfater - Fosforsyrans salter
- Fluorider - Fluorvätesyrans salter
- Citrater - Citronsyrans salter
- Acetater - Ättiksyrans salter
- Borater - Borsyrans salter
- Bensoater - Bensoesyrans salter
Källor
Noter
- ↑ Nordisk familjebok (1904–1926), Salter
- ↑ Hägg, Gunnar: Allmän och oorganisk kemi, Almqvist & Wiksell, Stockholm 1978, sjunde upplagan, sid. 306. ISBN 91-20-06123-4.
- ↑ Zumdahl, Steven S.: Chemistry, Houghton Mifflin Company, Boston, New York 2000, femte upplagan, sid. 694. ISBN 0-395-98581-1.
- ↑ Nationalencyklopedin, uppslagsordet Salter
- ↑ Silberberg, Martin S.: Chemistry, McGraw-Hill, New York 2003, tredje upplagan, sid. 142. ISBN 0-07-119894-6.