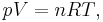Ideala gaslagen
Från Rilpedia
| Det har föreslagits att denna artikel bör slås ihop med ideal gas. (Diskutera) |
Ideala gaslagen eller allmänna gaslagen är en formel som beskriver sambandet mellan tryck, volym och temperatur hos en gas. Den allmänna gaslagen gäller egentligen enbart för så kallade ideala gaser (det vill säga inte för verkliga gaser). Avvikelserna är dock små om temperaturer ligger långt över gasens kokpunkt och om densiteten är mycket lägre än i den kondenserade vätskan. Därför kan formeln användas för till exempel luft.
För en sådan ideal gas gäller gasernas allmänna tillståndsekvation (pV )/T = konstant, som härledds ur Charles lag och Boyles lag. Genom att vidare använda sig av Avogadros lag får man den allmänna gaslagen:
där
- p = tryck
- V = volym
- n = substansmängd i mol
- R = gaskonstanten (8,3145 J mol-1 K-1)
- T = absolut temperatur i Kelvin.
Den ideala gaslagen kan härledas med hjälp av den kinetiska gasteorin om gasen:
- består av små partiklar (molekyler) som därför inte har någon volym utan kan anses som punkter.
- Dessa molekylär befinner sig i snabba rätlinjiga slumpmässiga rörelser. Rörelserna blir sicksacklika på grund av att partiklarna kolliderar med varandra. Medelvärdet av partiklarnas rörelseenergi beror på gasens temperatur.
- Molekylerna kolliderar med varandra och med behållarens väggar i en fullständigt elastisk kollision. Detta innebär att rörelsemängden och rörelseenergin är bevarade under kollisionen. Om molekylerna har en konstant rörelseenergi, innebär detta att man inte behöver ta hänsyn till deras kemiska energi eller annan form av energi (partiklarna har enbart rörelseenergi).
- Det förekommer ingen annan växelverkan mellan molekylerna och omgivningen än föregående punkter.
Flera generaliseringar av den ideala gaslagen har gjorts. Mest känd är van der Waals lag.
| Gaslagar |
| Avogadros lag | Boyles lag | Daltons lag | Ideala gaslagen | Van der Waals lag | Redlich-Kwongs ekvation | Peng-Robinsons ekvation | Lagen om korresponderande tillstånd |