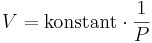Boyles lag
Från Rilpedia

Kompression och expansion med konstanthållen temperatur illustrerar Boyles lag; pV-diagrammet är en isoterm.
Boyles lag, uppkallad efter Robert Boyle, säger att volymen av en gas vid konstant temperatur är omvänt proportionell mot gasens tryck, alltså:
för volymen V och trycket P.
Detta kan lika gärna uttryckas som att produkten av en gas volym och tryck är konstant, vid konstant temperatur. Innebörden blir att om volymen för en behållare ökar så sjunker dess tryck och vice versa. Dessa entiteter är inverst propotionella.
| Gaslagar |
| Avogadros lag | Boyles lag | Daltons lag | Ideala gaslagen | Van der Waals lag | Redlich-Kwongs ekvation | Peng-Robinsons ekvation | Lagen om korresponderande tillstånd |