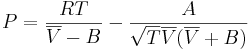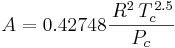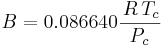Redlich-Kwongs ekvation
Från Rilpedia
Redlich-Kwongs ekvation är en tillståndsekvation för gaser som är bättre än van der Waals lag på att kvantitativt beskriva gasers tillstånd i temperatur- och tryckintervall nära där en gas övergår till vätska. Ekvationen har två parametrar som är specifika för olika gaser. Dessa brukar benämnas A och B, och kan antingen hittas i tabeller eller bestämmas ut ämnesspecifika data för kritiskt tryck och kritisk temperatur. Ekvationen har följande utseende:
Där
P är trycket
R är den allmänna gaskonstanten
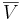 är den molära volymen
är den molära volymen
T är temperaturen
A och B är ämnesspecifika konstanter som beräknas enligt ekvationerna:
där
Tc är den kritiska temperaturen och
Pc är det kritiska trycket
| Ämne | A (dm6 bar mol-2 K1/2) | A (dm6 atm mol-2 K1/2) | B(dm3 mol-1) |
|---|---|---|---|
| Helium | 0,079905 | 0,078860 | 0,016450 |
| Väte | 1,4333 | 1,4145 | 0,018482 |
| Syre | 17,411 | 17,183 | 0,022082 |
| Kväve | 15,551 | 15,348 | 0,0267738 |
| Bensen | 453,32 | 447,39 | 0,082996 |
Källor
McQuarrie, Donald; John Simon: Molecular Thermodynamics, University Science Books, [1999] "2", (Engelska). ISBN 1-891389-05-X.
Referenser
- ↑ McQuarrie, Donald; John Simon: Molecular Thermodynamics, University Science Books, [1999] "2", (Engelska). ISBN 1-891389-05-X. ”Data är tagna ur tabell 2.4 på sidan 58”
| Gaslagar |
| Avogadros lag | Boyles lag | Daltons lag | Ideala gaslagen | Van der Waals lag | Redlich-Kwongs ekvation | Peng-Robinsons ekvation | Lagen om korresponderande tillstånd |