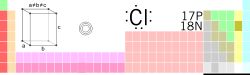
Klor
Från Rilpedia
För djurkroppsdelen, se klo.
|
|||||||||||||||||||||||||
| Allmänt | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Namn, kemiskt tecken, nummer | klor, Cl, 17 | ||||||||||||||||||||||||
| Ämnesklass | halogen | ||||||||||||||||||||||||
| Grupp, period, block | 17, 3, p | ||||||||||||||||||||||||
| Densitet | 3,214 kg/m3 (273 K) | ||||||||||||||||||||||||
| Hårdhet | - | ||||||||||||||||||||||||
| Utseende | gulaktigt grön |
||||||||||||||||||||||||
| Atomens egenskaper | |||||||||||||||||||||||||
| Atommassa | 35,453 u | ||||||||||||||||||||||||
| Atomradie (beräknad) | 100 (79) pm | ||||||||||||||||||||||||
| Kovalent radie | 99 pm | ||||||||||||||||||||||||
| van der Waalsradie | 175 pm | ||||||||||||||||||||||||
| Elektronkonfiguration | [ Ne ]3s23p5 | ||||||||||||||||||||||||
| e− per skal | 2, 8, 7 | ||||||||||||||||||||||||
| Oxidationstillstånd (oxid) | +1, -1, 3, 5, 7 (starkt sur) | ||||||||||||||||||||||||
| Kristallstruktur | ortorombisk | ||||||||||||||||||||||||
| Ämnets fysiska egenskaper | |||||||||||||||||||||||||
| Aggregationstillstånd | gas | ||||||||||||||||||||||||
| Magnetiska egenskaper | icke magnetisk | ||||||||||||||||||||||||
| Smältpunkt | 171,6 K (-101,5 °C) | ||||||||||||||||||||||||
| Kokpunkt | 239,11 K (-34,04 °C) | ||||||||||||||||||||||||
| Molvolym | 17,39 ·10-6 m3/mol | ||||||||||||||||||||||||
| Ångbildningsvärme | 10,2 kJ/mol | ||||||||||||||||||||||||
| Smältvärme | 3,203 kJ/mol | ||||||||||||||||||||||||
| Ångtryck | 3,67·106 Pa | ||||||||||||||||||||||||
| Ljudhastighet | - m/s vid 293,15 K | ||||||||||||||||||||||||
| Diverse | |||||||||||||||||||||||||
| Elektronegativitet | 3,16 (Paulingskalan) | ||||||||||||||||||||||||
| Värmekapacitet | 480 J/(kg·K) | ||||||||||||||||||||||||
| Elektrisk ledningsförmåga | - S/m (Ω−1·m−1) | ||||||||||||||||||||||||
| Värmeledningsförmåga | 0,0089 W/(m·K) | ||||||||||||||||||||||||
| 1a jonisationspotential | 1251,2 kJ/mol | ||||||||||||||||||||||||
| 2a jonisationspotential | 2298 kJ/mol | ||||||||||||||||||||||||
| 3e jonisationspotential | 3822 kJ/mol | ||||||||||||||||||||||||
| 4e jonisationspotential | 5158,6 kJ/mol | ||||||||||||||||||||||||
| 5e jonisationspotential | 6542 kJ/mol | ||||||||||||||||||||||||
| 6e jonisationspotential | 9362 kJ/mol | ||||||||||||||||||||||||
| 7e jonisationspotential | 11018 kJ/mol | ||||||||||||||||||||||||
| 8e jonisationspotential | 33604 kJ/mol | ||||||||||||||||||||||||
| 9e jonisationspotential | 38600 kJ/mol | ||||||||||||||||||||||||
| 10e jonisationspotential | 43961 kJ/mol | ||||||||||||||||||||||||
| Mest stabila isotoper | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
| SI-enheter & STP används om ej annat angivits | |||||||||||||||||||||||||
Klor (latinskt namn, Chlorum) är ett icke-metalliskt grundämne som tillhör gruppen halogener.
Innehåll |
Användning
Klor används vid tillverkning av kalciumhypoklorit( CaClO ) som används till klorering av simbassänger. I simbassänger används även natriumhypoklorit, (NaClO). Det har också använts som kemiskt vapen.
Egenskaper
Klor är en gulgrön gas med en mycket stark lukt och reagerar direkt med de flesta ämnen. Gasen är giftig och skapar stor irritation i andningsorganen vid inandning, vid högre koncentrationer är den dödlig.
Förekomst
Klor är vanligt i naturen och livsviktigt för nästan alla livsformer, däribland människan. Det förekommer främst som en jon i föreningar med malmer och mineraler.
Klorjonen är en del i många salter (klorider) och finns därför i stor mängd i saltvatten.
Upptäckt
Gasen upptäcktes först av den svenske kemisten Carl Wilhelm Scheele men fick sitt namn av Humphry Davy som hävdade att det var ett grundämne.
Kemisk struktur
Rent klor förekommer som klorgas med formeln Cl2.
Se även
Referenser
- Webbplatsen www.studera.com: Klor