Bensen
Från Rilpedia
| Bensen | |
|---|---|
 |
|
| Systematiskt namn | Bensen |
| Kemisk formel | C6H6 |
| Molmassa | 78,11 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 71-43-2 |
| SMILES | c1ccccc1 |
| Egenskaper | |
| Densitet | 0,874 g/cm³ |
| Löslighet (vatten) | 1,79 g/l |
| Smältpunkt | 5,5 °C |
| Kokpunkt | 80 °C |
| SI-enheter & STP används om ej annat angivits | |
Bensen (C6H6) är det enklaste aromatiska kolvätet. Det kallades tidigare bensol.
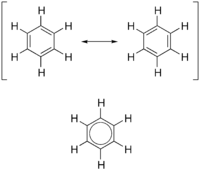
Trots att strukturformeln antyder att bensen borde bete sig som ett omättat kolväte, visar det sig vara mycket stabilt, och reagerar inte med brom på samma sätt som alkener eller alkyner. För att överhuvudtaget få det att reagera med brom, måste en katalysator i form av järntribromid, FeBr3, tillsättas. Reaktionen som sker då är en substitutionsreaktion, där en väteatom byts ut mot en bromatom.
Orsaken till att bensenmolkylen är så stabil är att de elektroner som enligt bilden ovan borde vara fria att bilda dubbelbindningar, så att varannan bindning är enkel, varannan dubbel, istället är delokaliserade och bildar en "bindning" som täcker hela molekylen. Detta fenomen kallas aromaticitet.
Det har visat sig att bensen är cancerframkallande, genom att kroppen via metabolismen inför en epoxid-grupp i molekylen. Denna är mycket reaktiv, och kan bland annat reagera med DNA. Numera används därför inte bensen som lösningsmedel i lika stor utsträckning som tidigare. Den ersätts ofta med toluen som har liknande egenskaper men inte är lika cancerframkallande. Bensen utgör i dag en tillsats i bensin, om än i begränsad utsträckning.
Under 2006 kom det larm om att läskedrycker kan innehålla spår av bensen. Som en kemisk reaktion mellan nedbrutna produkter av E 211 (natriumbensoat) och E 300 (askorbinsyra) kan bensen uppstå.[1][2]
Se även
- Lista över kolväten
- Toluen (metylbensen)
- Xylen (dimetylbensen)
Referenser
- ↑ http://www.svd.se/nyheter/inrikes/artikel_293012.svd SvD
- ↑ http://www.testfakta.se/Article.aspx?a=11603 Testfakta.se



