Nitrometan
Från Rilpedia
| Nitrometan | |
|---|---|
  |
|
| Systematiskt namn | Nitrometan |
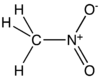
| Kemisk formel | CH3NO2 |
| Molmassa | 61,04 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 75-52-5 |
| SMILES | C[N+]([O-])=O |
| Egenskaper | |
| Densitet | 1,138 g/cm³ (vid 20 °C) |
| Löslighet (vatten) | 100 g/l |
| Smältpunkt | -29 °C |
| Kokpunkt | 101,2 °C |
| Ångbildningsvärme | 38,4 kJ/mol |
| Smältvärme | 9,71 kJ/mol |
| Kritisk temperatur | 315 °C |
| Kritiskt tryck | 6310 kPa |
| Förbränningsvärme | -711 kJ/mol |
| Säkerhet | |
| Förtäring | Kan orsaka njur- och leverskador. |
| Inandning | Irritation av luftvägar. |
| Hud | Kan orsaka rodnad och inflammation. |
| Ögon | Kan orsaka irritation. |
| SI-enheter & STP används om ej annat angivits | |
Nitrometan, eller CH3NO2, är en organisk molekyl. Det används bland annat som industriellt lösningsmedel och reaktant, men också som bränsle i motorsport, till exempel dragracing. I detta sammanhang kallas nitrometan ofta bara för nitro, och de största och snabbaste bilarna tävlar i klassen top fuel.
Eftersom nitrometan innehåller sitt 'eget' syre krävs mycket mindre syre i den omgivande luften för att uppnå full förbränning av till exempel bensin:
4CH3NO2 + 3O2 → 4CO2 + 6H2O + 2N2
Det krävs 14,6 kg luft för att förbränna 1 kg bensin, men bara 1,7 kg luft för att förbränna 1 kg nitrometan.
Nitrometan är explosivt vid kraftig upphettning. Det är så pass explosivt att man endast får ha en-liters behållare av ämnet i hemmet för att hemförsäkringen ska täcka. Större sammanlagda kvantiteter är dock tillåtna.



