Autokatalys
Från Rilpedia
Autokatalys (av grekiska: αυτοκατάλυση, aftokatálissi, "självupplösning") är en form av katalys av en kemisk reaktion där ett eller några ämnen som bildas i reaktionen påskyndar fortsatt reaktion; reaktionsprodukten är alltså en katalysator till reaktionen.
En mängd kemiska reaktioner kan sägas vara "kollektivt autokatalytiska", om några av reaktionerna producerar katalysatorer för tillräckligt många av de övriga reaktionerna så att alla reaktionerna är självgående givet en mängd energi och reaktionsmaterial.
Innehåll |
Exempel på autokatalys
- Exempel 1
- Vid lösning av koppar (Cu) i utspädd salpetersyra (HNO3) sker reaktionen inledningsvis mycket långsamt, men ökar efter ett tag betydligt genom bildningen av kväveoxid (NO) som fungerar som katalysator:
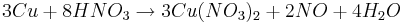
- Exempel 2
- Vid en reaktion mellan oxalsyra (HOOC-COOH) och permanganat (MnO4-) bildas manganjoner som utgör positiva katalysatorer för reaktionen.
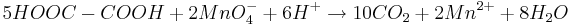
Reaktionshastighet vid autokatalytiska reaktioner
Hastighetsekvationen för en autokatalytisk reaktion av första ordningen
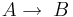 är
är ![\ v = k[A][B]](/w/images/sv.rilpedia.org/math/d/e/1/de10acc5c8a835e03ff527ffd5d6a61c.png) .
.
Koncentrationen hos A och B varierar i tiden enligt
![[A]=\frac{[A]_0+[B]_0}{1+\frac{[B]_0}{[A]_0}e^{([A]_0+[B]_0)kt}}](/w/images/sv.rilpedia.org/math/7/0/2/702f04dd65537d65853d6785c376928d.png)
och
![[B]=\frac{[A]_0+[B]_0}{1+\frac{[A]_0}{[B]_0}e^{-([A]_0+[B]_0)kt}}](/w/images/sv.rilpedia.org/math/a/2/e/a2e8f292ed1676b68823e5e5bdcff432.png) .
.
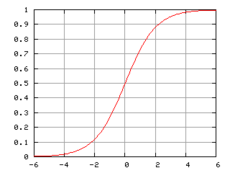
En graf över dessa reaktioner bildar en sigmoidal kurva som är typisk för autokatalytiska reaktioner. Initialt går reaktionerna trögt på grund av bristen på katalysatorer. Därefter ökar reaktionshastigheten alltmer, allt eftersom reaktionen fortskrider och mängden katalysatorer ökar. När koncentrationen av reaktanter minskar avtar reaktionshastigheten igen. Om koncentrationen av en reaktant eller produkt i ett experiment följer en sigmoidal kurva är reaktionen med stor sannolikhet autokatalytisk.
Abiogenes-hypotesen
Den brittiske etologen Richard Dawkins har i sin bok The Ancestor's Tale 2004 beskrivit autokatalys som en möjlig förklaring till abiogenes, det vill säga hur livet uppstod ur abiotiskt material. I sin bok nämner han ett experiment utfört av Julius Rebek och hans kollegor vid Scripps Research Institute i Kalifornien.
I experimentet kombinerade de aminoadenosin och pentafluorofenyl med autokatalysatorn aminoadenosintriacidester (AATE, amino adenosine triacid ester). Ett av de experimentella systemen innehöll varianter av AATE som katalyserade syntes av sig självt. Genom att de olika varianterna av AATE kom att tävla om reagensen, så sker en tävlan mellan de olika varianterna om vilken variant som under de givna betingelserna är den mest effektiva autokatalysatorn. Eftersom produkten av var och en av reaktionerna är identisk med det ursprungliga ämnet, så kan resultaten tolkas som att det mest "framgångsrika" ämnet, det vill säga det som lyckades duplicera sig självt i störst mängd, har vidarebefordrat sina egenskaper till en "avkomma". Därmed kan paralleller dras från autokatalysreaktioner till principen om naturligt urval, fastväl i en mycket rudimentär form.
Referenser
- Denna artikel var ursprungligen en översättning av motsvarande engelskspråkiga artikel den 9 september 2006