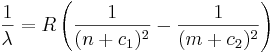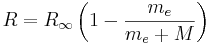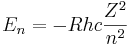Rydbergs formel
Från Rilpedia
Rydbergs formel upptäcktes 1888 av fysikern Janne Rydberg för att beräkna spektrallinjer från atomer. Han hade upptäckt en regelbundenhet i vågtalen av spektralserier som kunde skrivas som
där λ är det utstrålade ljusets våglängd, m och n är heltal sådana att m>n och c1 och c2 är tal mindre än 1 som är specifika för en viss serie. R är en universell konstant, som nu kallas Rydbergs konstant.
För väte gäller att konstanterna c1 = c2 = 0. Med det ena heltalet lika med 2, ger Rydbergs formel Balmerserien, en formel från 1885 som Rydberg inte hade känt till.
För lätta atomer finns det små avvikelser från den universella konstanten, och man kan skriva
där me är elektronmassan, M är atomkärnans massa. 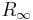 är Rydbergs konstant för oändlig massa (1,097 373 156 85 · 107 m-1) och R h c = 13,606 eV.[1] [2]
är Rydbergs konstant för oändlig massa (1,097 373 156 85 · 107 m-1) och R h c = 13,606 eV.[1] [2]
Rydbergs formel och konstantens värde kan enkelt förklaras med Bohrs atommodell, i vilken den potentiella energin för det n:e elektronskalet (det som ligger närmast kärnan har n=1) kan skrivas
h är Plancks konstant, c är ljusets hastighet. Eftersom frekvensen ν för ljus är relaterat till energin genom E=hν och våglängden är relaterat till frekvensen genom λ = c / ν kan man lätt se att Rydbergs formel uttrycker energiskillnaden mellan två skal uttryckt i våglängd.
Rydbergs formel för väte med fixt n ger en olika så kallade serier av övergångar:
| n | Serie | Våglängdsområde |
|---|---|---|
| 1 | Lymanserien | ultraviolett |
| 2 | Balmerserien | synligt ljus |
| 3 | Paschenserien | infrarött |
| 4 | Brackettserien | infrarött |
| 5 | Pfundserien | infrarött |
| 6 | Humphreyserien | infrarött |
Historik
1888 hade Rydberg upptäckt en formel som beskrev förhållandet mellan våglängderna i alkalimetallernas spektra, varvid Balmerserien föll ut som ett specialfall. Även om man senare upptäckte att Rydbergs formel inte ger exakt rätt svar för andra atomer än väte, så anses den fortfarande tillräckligt noggrann för väte och för atomer bland alkalimetallerna där en enda valenselektron befinner sig på långt avstånd från de övriga. 1906 började Lyman analysera den serie av vätes spektrallinjer i det ultravioletta området som man redan visste fanns och som sedan fick sitt namn efter honom.
Rydberg förenklade sina beräkningar genom att använda vågtalet (antalet vågor i en viss längdenhet) som sitt mätetal. Han plottade vågtalen för successiva linjer i varje serie mot på varandra följande heltal som motsvarade linjernas ordning i respektive serie. När han märkte att de resulterande kurvorna alla hade samma form, försökte ha finna en enkel funktion ur vilken alla serier kunde beräknas när rätt parametrar valts.
Källor
- Denna artikel är helt eller delvis baserad på material från engelskspråkiga Wikipedia
Fotnoter
- ↑ ”Rydberg constant”. 2006 CODATA recommended values. NIST. http://physics.nist.gov/cgi-bin/cuu/Value?ryd.
- ↑ ”Rydberg constant times hc in eV”. 2006 CODATA recommended values. NIST. http://physics.nist.gov/cgi-bin/cuu/Value?rydhcev.