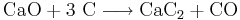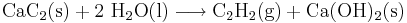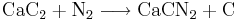Kalciumkarbid
Från Rilpedia
| Kalciumkarbid | |
|---|---|
 |
|
| Systematiskt namn | Calcium Carbide |
| Kemisk formel | CaC2 |
| Molmassa | 64,1 g/mol |
| Utseende | Från vitt pulver till grå-svarta kristaller |
| CAS-nummer | 75-20-7 |
| Egenskaper | |
| Densitet | 2,22 g/cm³ |
| Smältpunkt | 2 160 °C |
| Kokpunkt | 2 300 °C |
| Faror | |
| Huvudfara | Mycket brandfarlig (utsöndrar acetylengas vid kontakt med vatten) |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Kalciumkarbid är ett färglöst kemiskt salt med formeln CaC2. Kokpunkten är omkring 2 300 °C.[1]
Kalciumkarbid framställs genom den endoterma reaktionen mellan bränd kalk (CaO) och koks (C), en process som upptäcktes av kanadensarna T.L. Willson och J.T. Moorehead (1891):[2]
Kalciumkarbidets kemiska struktur påminner om koksaltets, där Na+-jonen bytts ut mot en Ca2+-jon och Cl--jonen bytts ut mot C22--joner.
Innehåll |
Industriell tillverkning
Industriellt används kalciumkarbid vid framställning av acetylen (C2H2), som sedan används vid oxyacetylensvetsning. Reaktionen som uppstår då kalciumkarbid kommer i kontakt med vatten är kraftigt exoterm.
Kalciumkarbid tillverkas i stora mängder, 1982 var den totala världsproduktionen 6,4 miljoner ton och utvinns bland annat vid krackning av kolväten och fås som biprodukt vid framställning av etylen. En annan industriell tillämpning av kalciumkarbid är fixering av kvävgasen i luften och därigenom bildas ämnet kalciumcyanamid, som används som gödsel.
Tillämpningar
Ett exempel på vanlig tillämpning är som bränsle i karbidlampor. Kalciumkarbid finns att köpa i vissa färg/kemi-affärer och kan användas vid sorkbekämpning i trädgårdar.
Kalciumkarbids främsta användingsområde är dock i stålindustrin där den används för att rena stål från svavelföreningar och för tillverkning av acetylengas till svetsindustrin.
Referenser
Litteratur
- John McMurry och Robert C. Fay: Chemistry, Prentice Hall, 2003, fourth ed. ISBN 978-013-140208-9.
- N. N. Greenwood och A. Earnshaw: Chemistry of the Elements, Butterworth-Heinemann, 1998, second ed. ISBN 978-075-063365-9.
Noter
- ↑ ”Säkerhetsdatablad”. Swed Handling AB, Norrköping. 2007-06-26. http://www.swedhandling.com/pdf/158.pdf. Läst 8 februari 2009.
- ↑ ”Electricity & Technology at the Pan-American Exposition”. University at Buffalo. 11 juni 2004. http://ublib.buffalo.edu/libraries/exhibits/panam/sel/electrochemcompanies.html. Läst 29 februari 2008.