Bränslecell
Från Rilpedia
En bränslecell omvandlar direkt kemisk energi till elektrisk energi. Tack vare att energiomvandlingen är kemisk, begränsas inte verkningsgraden av den så kallade Carnotverkningsgraden som begränsar förbränningsbaserade energisystem. Bränslecellen kan liknas vid ett batteri som kan "tankas" med ett bränsle. Det vanligaste bränslet är vätgas som är det bränsle som enklast kan sönderdelas elektrokemiskt. I vissa typer av bränslecellsystem använder man en så kallad reformer som omvandlar ett kolvätebaserat bränsle, exempelvis naturgas, metanol eller DME (DiMetylEter) till vätgas och koldioxid.
Innehåll |
Historik
Principen bakom bränslecellen upptäcktes 1838 av Christian Friedrich Schönbein och publicerades i januari 1839 i tidskriften "Philosophical Magazine". 1843 utvecklade Sir William Robert Grove en första tillämpning av Schönbeins forskningsresultat och använde då liknande material som moderna fosforsyrabränsleceller. Det var inte förrän 1959 som Francis Thomas Bacon framgångsrikt utvecklade en 5 kW stationär bränslecell.
I slutet på 50-talet blev NASA intresserade av tekniken då man lyckades tillverka en bränslecell som drev ett litet svetsaggregat. Därefter har NASA bekostat över 200 projekt och bränslecellerna fick sitt första användningsområde som kraftförsörjningskälla i NASA: s månfärder. Apollofarkosterna var utrustade med bränsleceller av alkalityp med väte som bränsle och syre som oxidationsmedel.
Bränslecellstyper
Bränsleceller namnges vanligen av den elektrolyt som används i bränslecellen
PAFC - Fosforsyrabränslecell (Phosphoric Acid Fuel Cell)
PEMFC - Polymerelektrolytbränslecell (Polymer Electrolyte Membrane Fuel Cell)
MCFC - Smältkarbonatbränslecell (Molten Carbonate Fuel Cell)
SOFC - Fastoxidbränslecell (Solid Oxide Fuel Cell)
AFC - Alkalisk bränslecell (Alkaline Fuel Cell)
DMFC - Direktmetanolbränslecell (Vanligen av PEFC-typ).
Kemiska reaktioner
Anodreaktion: 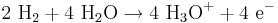 (Oxidation och elektronavgivning)
(Oxidation och elektronavgivning)
Katodreaktion: 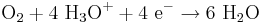 (Reduktion och elektronupptagning)
(Reduktion och elektronupptagning)
Totalreaktion: 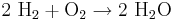 (Redoxreaktion)
(Redoxreaktion)
En bränslecell kan ge en spänning på 0,7-1 Volt och effekt på 1 Watt per kvadratcentimeter. Således krävs att ett antal celler seriekopplas för önskad spänning. Ett antal seriekopplade celler tillsammans med ändplattor som mekaniskt håller cellerna samman kallas bränslecellstack.
Bränslecell som sensor
Bränsleceller används som sensorer vid gasmätning. Till skillnad från det vanliga användingsområdet, när man vill utnyttja energin, mäts istället strömmen som genereras vid den kemiska reaktionen. Bränsleceller i mätsammanhang benämns vanligtvis elektrokemiska sensorer. För att mäta aktuell gas integreras strömmen över tid. Resultatet motsvarar antalet molekyler av den aktuella gasen. Vid en känd volym kan sedan koncentrationen räknas ut.
Vanliga gaser att analysera med hjälp av en elektrokemisk sensor är:
Bränsleceller i fordon
FCV står för Fuel Cell Vehicles och är en benämning på fordon som drivs med bränsleceller.
Se även
- Wikimedia Commons har media som rör Bränslecell
- Ackumulator
- Batteri
Externa länkar
- Elenergi från bränsleceller
- CUTE-projektet
- zeab.se - Information om vätgas och bränsleceller
- Elforsk rapporter
- Morphic ett bolag som är mycket långt fram i bränslecellsutvecklingen
- Mistras bränslecellsprogram





_(176825761).jpg/180px-F-Cell_(p6250813)_(176825761).jpg)