Dissociationskonstant
Från Rilpedia
Inom kemi och biokemi är dissociationskonstant en speciell typ av jämviktskonstant som mäter benägenheten hos ett större komplex att sönderfalla reversibelt i mindre delar, t ex. när en molekyl i lösning delas upp i joner. Dissociationskonstanten betecknas vanligen Kd och det inverterade värdet kallas affinitetskonstant.
För en allmän kemisk reaktion
i vilken komplexet AxBy sönderdelas i x A subenheter och y B subenheter är dissociationskonstanten
där {A}, {B}, och {AxBy} är aktiviteterna av A, B, och komplexet AxBy respektive. Då koncentrationerna är tillräckligt låga kommer aktiviteterna att ligga mycket nära koncentrationerna och kan därför ersättas av dem.
Innehåll |
Ligandbindning
Dissociationskonstanten används ofta för att karakterisera bindningen mellan en ligand (L) (t ex en drog eller en inhibitor till ett enzym) och ett bindningsställe på en cell eller på ett enzym (P) d v s för att ange hur starkt liganden binder till sitt bindningsställe. I detta sammanhang betecknas dissociationskonstanten ofta bindningskonstant. Elektrostatisk växelverkan, hydrofob interaktion och van der Waals-krafter orsakar den stereospecifika bindningen.
Bildningen av ligandkomplexet (C) kan beskrivas av reaktionen
Där den motsvarande dissociationskonstanten är
Där [P], [L] och [C] är koncentrationerna av bindningsställe, ligand och komplex.
Dissociationskonstanten uttrycks alltså i koncentrationsenheter. Det motsvarar den koncentration av fri ligand vid vilken hälften av bindningsställena är bundna, d v s där mängden av fria bindningsställen är lika med mängden av bindningsställen bundna till ligand. Ju lägre dissociationskonstanten, dess starkare bunden är liganden och dess högre är affiniteten mellan ligand och bindningsställe.
Om bindningen inte är kovalent är dissociationskonstanter lägre än nanomolära sällsynta. Det finns emellertid några exempel. Biotin (vitamin B8) och avidin (ett protein från äggvita) binds med en dissociationskonstant på omkring 10 − 15 M = 1 fM = 0.000001 nM.[1] Inhibitorer till ribonukleas kan också binda sig till ribonukleas med jämförbar styrka.[2]
Dissociationskonstanten för en given ligandbindning kan variera starkt med betingelserna i lösningen, så som temperatur, pH och saltkoncentration.
Farmakologiskt aktiva substanser kan åstadkomma oönskade bieffekter om de binder sig till andra ställen än de där de är avsedda utöva sin effekt. Därför inriktas mycket farmakologisk forskning på att ta fram substanser som endast binder sig till de eftersträvade bindningsställena och som binder sig där med hög affinitet.
Ett annat sätt att ange dissociationskonstanten
Dissociationskonstanten Ka anges ofta med hjälp av operatorn p
pKa
med definitionen::
- pKa = − log10Ka
Dissociation av vatten
Ett specialfall är dissociationen av vatten där dissociationskonstanten, vattnets autoproteolyskonstant, är Kw:
Kw = [H + ][OH − ]
(Aktiviteten av odissocierat vatten ![\left[ \mbox{H}_2\mbox{O} \right]](/w/images/sv.rilpedia.org/math/0/7/9/0790e5e6b5eab215ab1c4bcfe59ba835.png) utesluts ur definitionen enligt konventionen att vattnets aktivitet är sortlöst 1.)
utesluts ur definitionen enligt konventionen att vattnets aktivitet är sortlöst 1.)
Värdet av Kw varierar med temperaturen som framgår av tabellen nedan. Detta måste tas med i beräkningen vid noggranna beräkningar av bland annat pH och vid räkningar med syra-bas-jämvikter.
| Vattentemperatur | Kw*10-14 | pKw |
|---|---|---|
| 0°C | 0.1 | 14.92 |
| 10°C | 0.3 | 14.52 |
| 18°C | 0.7 | 14.16 |
| 25°C | 1.2 | 13.92 |
| 30°C | 1.8 | 13.75 |
| 50°C | 8.0 | 13.10 |
| 60°C | 12.6 | 12.90 |
| 70°C | 21.2 | 12.67 |
| 80°C | 35 | 12.46 |
| 90°C | 53 | 12.28 |
| 100°C | 73 | 12.14 |
Syra-bas-reaktioner
För dissociation av syror betecknas dissociationskonstanten Ks, syrakonstanten. Starka syror, t ex svavelsyra, har höga dissociationskonstanter, svaga syror, t ex ättiksyra har lägre. En syra som dissocieras i flera steg har motsvarande flera dissociationskonstanter. När det gäller syror med flera dissociationssteg betecknar man motsvarande dissociationskonstanter med siffror. Också ivid dissociation av syror och baser använder man vid beräkningar operatorn p och en trebasisk syra, t ex citronsyra eller fosforsyra har syrakonstanterna: pKs1, pKs2, pKs3 respektive. För aminosyror gäller att pKs1 hänför sig till karboxylgruppen (-COOH), pKs2 hänför sig till aminogruppen (-NH3) och pKs3 är pK värdet hos sidokedjan.
![H_3 B \rightleftharpoons\ H ^ + + H_2 B ^ - \qquad K_{s1} = {[H ^ +] \cdot [H_2 B ^ -] \over [H_3 B]} \qquad pK_{s1} = - log K_{s1}](/w/images/sv.rilpedia.org/math/2/c/f/2cfb8c364161cf2d690ce7133f356046.png)
![H_2 B ^ - \rightleftharpoons\ H ^ + + H B ^ {-2} \qquad K_{s2} = {[H ^ +] \cdot [H B ^{-2}] \over [H_2 B^ -]} \qquad pK_{s2} = - log K_{s2}](/w/images/sv.rilpedia.org/math/8/a/4/8a4ba5e85dc5ba3a7b151801745309dd.png)
![H B ^{-2} \rightleftharpoons\ H ^ + + B ^{-3} \qquad K_{s3} = {[H ^ +] \cdot [ B ^ {-3}] \over [H B ^ {-2}]} \qquad pK_{s3} = - log K_{s3}](/w/images/sv.rilpedia.org/math/5/0/e/50eba1202f827ac3ea5ea119fec7495d.png)
pK-värden används sedan vid beräkningar av pH i buffertlösningar, för att bestämma deras buffertkapacitet och för att utreda optimala betingelser för titreringar. För baser anger man baskonstanten Kb, där produkten av syrakonstanten Ks och baskonstanten Kb skall vara vattnets autoprotolyskonstant Kw.
Referenser
- Denna artikel är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Dissociation constant
- ↑ Livnah O, Bayer EA, Wilchek M, Sussman JL., Three-dimensional structures of avidin and the avidin-biotin complex (1993) Proc Natl Acad Sci USA.. 90. (11).sid. 5076-5080. PMID 8506353.
- ↑ Johnson RJ, McCoy JG, Bingman CA, Phillips GN Jr, Raines RT, Inhibition of human pancreatic ribonuclease by the human ribonuclease inhibitor protein (2007) J Mol Biol.. 368. (2).sid. 434-449. PMID 17350650.




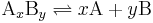
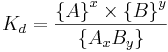
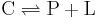
![K_{d} = \frac{\left[ \mathrm{P} \right] \left[ \mathrm{L} \right]}{\left[ \mathrm{C} \right]}](/w/images/sv.rilpedia.org/math/0/2/d/02d9662e84613b8f2ab83ae3d30de36c.png)