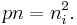Massverkans lag
Från Rilpedia
Massverkningslagen ger för en reversibel kemisk reaktion sambandet mellan reaktanternas aktiviteter vid kemisk jämvikt:
Här är
- K = reaktionens jämviktskonstant;
- a = de olika ämnens aktivitet, lika med deras koncentration om aktivitetskoefficienten är lika med 1;
- ν = den stökiometriska koefficienten, med positiv tecken för reaktionsprodukter och negativ tecken för reagens.
Exempel: vatten
En känd jämviktsreaktion är vattnets autoprotolys: 2H2O <-> OH- + H3O+. Då gäller i termer av koncentrationer:
Efterom vattenkoncentrationen är praktiskt tagen konstant, definierar man vattenkonstanten Kw = [OH-]·[H+] = 10-14 vid 25 °C. I rent vatten finns det lika många hydraterade protoner som hydroxyljoner, så att deras koncentrationer är 10-7 och pH är 7,0. Massverkningslagen säger att koncentrationen hydroxyljoner minskar proportionellt när man tillsätter en syra; pH + pOH = 14 (vid 25°C).
Halvledarfysik
Inom fysiken av halvledare talar man om elektroner i ledningsbandet och hål i valensbandet. Dessa kan rekombinera (annihilera varandra). Vid termodynamisk jämvikt är rekombination lika stor som termisk generation av nya elektron-hål-par. Genom dopning med små mängder störämnen kan man tillföra extra hål eller elektroner. Massverkanslag säger att produkt av hålkoncentrationen p och elektronkoncentrationen n inte beror på dopning och är lika med produktet av deras intrinsiska koncentrationer pi = ni i den odopade halvledaren:




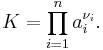
![K = \frac{[{\rm OH}^-][{\rm H_3O}^+]}{[{\rm H_2O}]^2}.](/w/images/sv.rilpedia.org/math/e/f/f/effed9e222b39c267ac1b7402a525953.png)