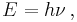Foton
Från Rilpedia
Foton [fot'ån], det elektromagnetiska fältets energikvantum. Namnet kommer från grekiskans φως (phos), "ljus". Fotonens energi är
där h är Plancks konstant och ν det elektromagnetiska fältets svängningsfrekvens. Rörelsemängden är hν/c, där c är ljushastigheten i vakuum. Ljus (liksom annan elektromagnetisk strålning och materia) har enligt kvantteorin såväl våg- som partikelegenskaper. Vågegenskaperna syns när det passerar ett gitter, eftersom det då uppvisar interferens. Partikelegenskaperna syns i den fotoelektriska effekten. Fotonen beskrivs ibland därför som ett vågpaket. Fotonen är också en elementarpartikel av typen boson och bärare av den elektromagnetiska växelverkan.
Liksom alla andra kraftbärande elementarpartiklar är en foton i någon mån immateriell. Den har en energi, en frekvens, och en rörelsemängd, men begrepp som massa, storlek och läge kan inte definieras på ett meningsfullt sätt. Det närmaste man kan komma är säga att den fyller ut hela det rum den kan finnas i, och att ge den en ekvivalent massa i form av av ren rörelseenergi enligt formeln E = mc2. Fotonen kan aldrig vara i vila och saknar således vilomassa. Fotoner har en symmetrisk vågfunktion som får överlappa den av andra fotoner. Man kan säga att fotoner kan staplas på varandra och det finns alltså ingen gräns för hur många fotoner som får plats i ett rum.
| Färg | Våglängdsområde | Frekvensområde |
|---|---|---|
| Röd | ~ 625-740 nm | ~ 480-405 THz |
| orange | ~ 590-625 nm | ~ 510-480 THz |
| Gul | ~ 565-590 nm | ~ 530-510 THz |
| Grön | ~ 520-565 nm | ~ 580-530 THz |
| Cyan | ~ 500-520 nm | ~ 600-580 THz |
| Blå | ~ 450-500 nm | ~ 670-600 THz |
| indigo | ~ 430-450 nm | ~ 700-670 THz |
| Violett | ~ 380-430 nm | ~ 790-700 THz |
När en elektron i en atom byter tillstånd till ett med lägre energinivå, och alltså förlorar potentiell energi, genereras en foton med en energimängd, ett ljuskvantum, som motsvarar den energi som elektronen förlorade. De energinivåer som elektronerna kan ha i ett visst ämne har vissa bestämda värden, kvantnivåer, beroende på vilket elektronskal de tillhör. Ljus har därför karaktäristiska frekvenser som beror på vilket ämne de framställts i. Relativt vanligt är till exempel det gula natriumljuset, och ljuset från lysdioder, som alltså kommer från rena ämnen. Vid brytning i ett prisma erhålles på så sätt s k emissionslinjer.
Även det omvända förekommer. I ljus som från början var kontinuerligt spritt över spektrum och som färdats genom interstellär gas kan man se att fotoner med vissa frekvenser saknas. De har fångats upp av gasen genom att excitera dess elektroner. Fotonens energi måste stämma med befintliga skillnader mellan tillåtna värden för elektronens energi. Därför kan svarta linjer, absorptionslinjer, som är karaktäristiska för gasen i fråga ses i spektret.