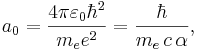Bohrs atommodell
Från Rilpedia
Bohrs atommodell är den av Niels Bohr 1913 uppställda teorin för atomen enligt vilken elektronerna rör sig i cirkulära banor runt atomkärnan, där centripetalkraften ges av coulombkraften och rörelsemängdsmoment är kvantiserad till ett heltal gånger Plancks konstant, nh/2π. Detta leder till att elektronen endast kan inta vissa specifika energinivåer. Då elektronen faller till en lägre energinivå utsändes ljus. När energinivån ökar, absorberas ljus. Med modellen kunde Bohr förklara spektrallinjerna hos väteatomen. En atom som beskrivs av denna modell kallas ofta Bohratom.
Förutom en fysikalisk förklaring för Rydbergs formel för spektrallinjerna av väte, gav Bohrs modell även storleken för atomerna. Omloppsbanans radie blir
där ε0 är den elektriska konstanten, 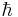 är Plancks konstant dividerad med 2π,
är Plancks konstant dividerad med 2π, 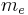 är elektronens massa,
är elektronens massa, 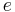 är elementarladdningen,
är elementarladdningen, 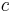 är ljushastigheten och α är finstrukturkonstanten. Värdet av Bohrradien
är ljushastigheten och α är finstrukturkonstanten. Värdet av Bohrradien 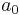 är 0,53 ångström = 53 picometer.[1]
är 0,53 ångström = 53 picometer.[1]
Fotnoter
- ↑ ”Bohr radius”. 2006 CODATA recommended values. NIST. http://physics.nist.gov/cgi-bin/cuu/Value?bohrrada0.