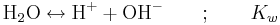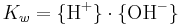Vattnets autoprotolys
Från Rilpedia
Vattnets autoprotolys innebär att en liten del av vattenmolekylerna alltid dissocierar till oxoniumjoner och hydroxidjoner. Reaktionen kan skrivas på följande sätt (OBS att oxoniumjonerna här skrivs som vätejoner!)
där Kw är en jämviktskonstant som definieras utifrån villkoret att aktiviteten för vattenmolekylen, H2O, sätts till 1. Vi får:
där {H+} och {OH-} är aktiviteterna av vätejoner respektive hydroxidjoner. Konstanten Kw har ett värde på 10-14,00 vid 25 °C (298,15 K). Ofta anger man konstanten som en minuslogaritm:
pKw = -log10 Kw
Temperaturberoende
Konstanten för vattnets autoprotolys har ett ganska stort temperaturberoende, se nedanstående tabell:
| Temperatur (°C) | pKw |
|---|---|
| 0 | 14,89 |
| 5 | 14,70 |
| 10 | 14,51 |
| 15 | 14,33 |
| 20 | 14,16 |
| 25 | 14,00 |
| 30 | 13,84 |
I avjoniserat vatten helt utan atmosfärskontakt styrs pH av vattnets autoprotolys. Laddningsvillkoret för detta system säger att koncentrationen vätejoner måste vara lika stor som koncentrationen hydroxidjoner. pH blir därmed = 7,00 vid 25°C. Vid 0°C blir pH däremot 7,44, beroende på temperaturberoendet hos pKw.
I naturen är dock vattnets autoprotolys i praktiken aldrig viktig för pH-värdet. Istället styrs pH i naturliga vatten oftast av syrabasreaktioner med luftens koldioxid.
Se även
Litteratur
- M.M. Benjamin. 2002. Water Chemistry. McGraw-Hill.