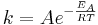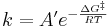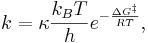Arrhenius ekvation
Från Rilpedia
Arrhenius ekvation är en ekvation som bestämmer en kemisk reaktions hastighet vid en viss temperatur genom att utgå från aktiveringsenergin och sannolikheten för lyckosamma kollisioner mellan molekylerna. Lagen är uppkallad efter Svante Arrhenius.
Vid temperaturen T har en molekyl den termiska energin RT, där R är den allmänna gaskonstanten (8,314570 J·K-1·mol-1). Bråkdelen av de molekyler som har en energi som överstiger den s.k. aktiveringsenergin EA bidrar exponentiellt till reaktionshastigheten k, eller formulerat med arrhenius-ekvationen,
där A-faktorn eller frekvensfaktorn A är en konstant som beror av sannolikheten för att molekylerna ska kollidera i det korrekta läget. Ekvationen visar att reaktionshastigheten k ökar antingen genom att sänka aktiveringsenergin (EA) eller genom att öka temperaturen.
Ekvationen har också den mer generalla formen
där A' kan bestämmas genom statistiska metoder (statistisk mekanik) och beror av formen på komplexets energiyta; ΔG‡ är Gibbs fria energi. I enkla fall är
där κ är transmissionskoefficienten (ett värde mellan 0 och 1), kB är Boltzmanns konstant, T är temperaturen och h är Plancks konstant.