Elektrokemisk cell
Från Rilpedia
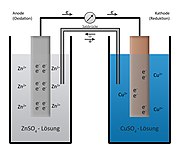
Elektrokemisk cell, konstruktion där två material sätts ihop och skapar en elektromotorisk kraft av de kemiska reaktioner som uppstår. Strömmen orsakas av reaktioner, där elektroner både frigörs och upptas i elektroderna. Det finns två typer av elektrokemiska celler: galvanisk cell och elektrolytisk cell.
I en halvcell uppstår antingen en oxidation- eller en reduktionsreaktion. I en hel elektrokemisk cell frigörs elektroner i ena elektrodänden (oxidation), medan den andra elektrodänden upptar elektroner (reduktion). Om atomerna/jonerna som är del av reaktionen är metaller, används samma metall i varje elektrod. Om atomerna/jonerna i reaktionen i varje halvcell inte är metaller så kan ingen elektrod konstrueras. Men i sådana fall kan icke-reaktiva metaller, som exempelvis platina, användas som elektrod.
Se även