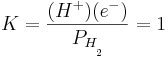Väte-elektrod
Från Rilpedia
Väte-elektrod används som standardreferenens för elektrodpotential. Där sker halvreaktionen
- H+(aq) + e-(aq)
 ½H2(g)
½H2(g)
där jämviktskonstaten blir
där
(H+) = vätejonsaktiviteten
(e- = elektronaktiviteten
PH2 = Partialtrycket av vätgas (atm)
I logaritmisk form blir K
- log K = log (H+) + log (e-) -log (PH2) = 0
Då pH = - log (H+) och pE = - log (e-) kan uttrycket också skrivas
- - pH - pE - log (PH2) = 0
d.v.s.
- pE + pH + log (PH2) = 0
- pE = -pH - log log (PH2)
När väte-elektrod används som standardreferens vid elektrodpotential, är pE = 0, pH = 0 och (PH2) 1 atmosfär.