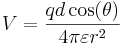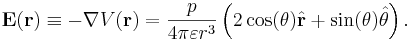Elektrisk dipol
Från Rilpedia
En elektrisk dipol är inom fysiken två elektriska laddningar med samma magnitud men olika tecken placerade med ett litet inbördes avstånd.
Om laddningarna är q och − q, placerade i (0,0,d/2) respektive (0,0,-d/2), blir den elektriska potentialen 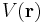 där
där  som följer
som följer
där 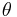 är vinkeln mellan positiva z-axeln och vektorn
är vinkeln mellan positiva z-axeln och vektorn 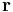 , och
, och 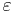 är permittiviteten.
är permittiviteten.
E-fältet blir
Fältstyrkan avtar alltså med tredje potensen av avståndet.
Dipoler inom kemi
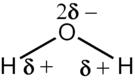
Molekyler kan vara elektriska dipoler, om de är uppbyggda av atomer av olika grundämnen och alltså med olika elektronegativitetsvärde bundna med kovalent bindning. De olika elektronegativitetsvärdena gör att molekylen får en ojämnt fördelad laddning även om den totalt sett är oladdad. Tvåatomiga molekyler är alltid dipoler om inte båda atomerna är av samma slag, men när molekylerna består av fler än två atomer av olika slag avgör deras geometriska form om de blir dipoler eller inte. Molekyler som är dipoler orienterar sig i förhållande till varandra så att positiva sidor närmar sig andra molekylers negativa sidor. Genom att olika laddningar attraherar varandra uppstår det dipol-dipolbindningar mellan molekylerna.
Se även
Källor
- Cheng, David K: Fundamentals of Engineering Electromagnetics, Addison Wesley, 1993.