Laminin
Från Rilpedia
Laminin är den huvudsakliga icke-kollagiena komponenten i basala lamina som t.ex. det som epitelceller sitter på.[1] Mer specifikt är laminin är ett protein som förekommer i den "extracellulära matrixen", det lager av protein som bildar substratet för alla interna organ, även kallat "basement membrane". Den har fyra armar, som kan bida till fyra andra molekyler. De tre kortare armarna är särskilt bra på att binda till andra laminin-molekyler, vilket är orsaken till att laminin är så bra på att bilda proteinlager. Den långa armen kan binda till celler som hjälper att förankra det aktuella organet till membranet.
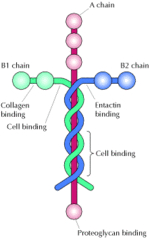
Lamininproteinet är uppbyggt av tre separata delar, som kallas A-, B1-, och B2-kedjor. Detta ger totalt sex "ändar", som står för en stor del av dess flexibilitet i att binda till olika sorts molekyler. På grund av detta är biomaterial-forskare extremt intresserade av hela familjen av lamininer. De är en familj av glykoproteiner som är en integrerad del av den strukturella grundstommen i nästan alla djur- och människovävnader. Lamininer utsöndras och inkorporeras i den extracellulärar matrixen runt celler.
Laminin är livsviktig för att se till att den övergripande kroppsstrukturen hålls ihop. Problem i produktion av laminin kan göra att musklerna formas felaktigt, vilket kan leda till en form av muskeldystrofi. Det kan även orsaka progeri.
Innehåll |
Typer av laminin
Varje lamininmolekyl är en trimer, uppbyggd av alfa-, beta-, och gamma-kedjor.[2]
Man har identifierat 15 laminin trimerer.
Nätverk
Lamininer bildar ett fristående nätverk, och är assorcierade med typ IV kollagen-nätverk via entactin, och perlecan. De binder också till cellmembran via integrin receptorer och andra plasmamembran-molekyler, som dystroglycan glycoproteinkomplexet och Lutheran blodgrupp glykoprotein.[1] Genom dessa interatktioner, bidrar laminin på ett avgörande sätt till cellfastsättning och differentiering, cellform och rörelse, underhåll av vävnadsfenotyp, och främjandet av vävnadens överlevnad..[1][2] Vissa av dessa av laminins biologiska funktioner har kunnat kopplas till specifika aminosyrasekvenser eller fragment av laminin.[1] T.ex. , peptidsekvensen [GTFALRGDNGDNGQ], som är placerad på alfakedjan av lamininet, främjar vidhäftning av endotelceller.[3]
Patologi
Ickefunkgerande (dysfunktionella) struktur hos ett specifikt laminin, laminin-2, är orsaken till en form av congenital muscular dystrophy[4]. Laminin-2 består av en α2, en β1 och en γ1 kedja. Detta laminins förekmmer i hjärnan och i muskelfibrer. I musklerna, binder det till alfa-dystroglylan och integrin alpha7-beta1 via G domänen, och via den andra änden binder den till den extracellulära matrixen.
Referenser
- ↑ 1,0 1,1 1,2 1,3 M. A. Haralson and John R. Hassell (1995). Extracellular matrix: a practical approach. Ithaca, N.Y: IRL Press. ISBN 0-19-963220-0.
- ↑ 2,0 2,1 Colognato H, Yurchenco P (2000). "Form and function: the laminin family of heterotrimers". Dev. Dyn. 218 (2): 213–34. DOI:<213::AID-DVDY1>3.0.CO;2-R 10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R. PMID 10842354.
- ↑ Beck et al., 1999.
- ↑ Hall, TE et al (2007). Proc Natl Acad Sci USA 104 (17), 7092-7097 doi: 10.1073/pnas.0700942104