Jonstyrka
Från Rilpedia
Jonstyrkan är ett mått på innehållet av lösta joner i lösningar (t.ex. vatten). Den används inom kemin bland annat i samband med beräkningar av aktivitetskoefficienter för kemisk jämvikt. Jonstyrkan I definieras så här:
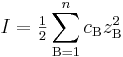
där cB är koncentrationen av jon B i mol/l, zB är jonens laddning, och summan går över alla joner i lösningen. För en natriumkloridlösning, där de ingående jonernas laddning = 1, är jonstyrkan lika med koncentrationen i mol/l. Däremot för t.ex. en lösning bestående av magnesiumsulfat, MgSO4, blir jonstyrkan högre (fyra gånger högre i detta fall).
I icke-ideala lösningar, som t.ex. i lösningar med mycket höga jonstyrkor (i storleksordningen 1 mol/l eller högre), är det bättre att använda molaliteter (d.v.s. koncentrationer i mol/kg) i stället för koncentrationer. Jonstyrkan definieras i detta fall som:
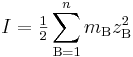
där mB står för molaliteten av jon B.
Jonstyrka i vatten - några exempel
| Typ av vatten | Jonstyrka (mol/l) |
|---|---|
| Avjoniserat vatten | 0 |
| Svenska sjöar (oligotrofa) | 0,0004-0,001 |
| Svenska sjöar (eutrofa) | 0,003-0,01 |
| Stockholms dricksvatten | 0,004 |
| Havsvatten | 0,7 (dock lägre i Östersjön) |
| Döda Havet | 8,5 (enhet mol/kg) |
Litteratur
- M.M. Benjamin. Water chemistry (2002, McGraw-Hill).



