Laminin
Från Rilpedia
(Mer begriplig inledning för vanligt folk) |
|||
| Rad 3: | Rad 3: | ||
'''Laminin''' är ett livsviktigt protein som ser till att den övergripande kroppsstrukturen hålls ihop. Mer specifikt är '''laminin''' ett protein som förekommer i det lager av protein som bildar ett underlag för alla interna organ, även kallat "basement membrane", eller den "extracellulära matrixen". Proteinet har fyra armar, som kan binda till fyra andra molekyler. De tre kortare armarna är särskilt bra på att binda till andra '''laminin'''molekyler, vilket förklarar varför laminin är så bra på att bilda lager av proteinnätverk. Den långa armen kan binda till celler som hjälper att förankra det aktuella organet till membranet. | '''Laminin''' är ett livsviktigt protein som ser till att den övergripande kroppsstrukturen hålls ihop. Mer specifikt är '''laminin''' ett protein som förekommer i det lager av protein som bildar ett underlag för alla interna organ, även kallat "basement membrane", eller den "extracellulära matrixen". Proteinet har fyra armar, som kan binda till fyra andra molekyler. De tre kortare armarna är särskilt bra på att binda till andra '''laminin'''molekyler, vilket förklarar varför laminin är så bra på att bilda lager av proteinnätverk. Den långa armen kan binda till celler som hjälper att förankra det aktuella organet till membranet. | ||
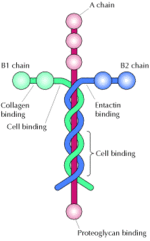
| - | Laminin är den huvudsakliga icke-kollagiena komponenten i [[basala lamina]] som t.ex. det [[epitel]]celler sitter på | + | Laminin är den huvudsakliga icke-kollagiena komponenten i [[basala lamina]] som t.ex. det [[epitel]]celler sitter på<ref name="Haralson">{{cite book |author=M. A. Haralson and John R. Hassell |title=Extracellular matrix: a practical approach |publisher=IRL Press |location=Ithaca, N.Y |year=1995 |pages= |isbn=0-19-963220-0 |oclc= |doi=}}</ref>, och är uppbyggt av tre separata delar, som kallas A-, B1-, och B2-kedjor. Detta ger totalt sex "ändar", som står för en stor del av dess flexibilitet i att binda till olika sorts molekyler. På grund av detta är biomaterial-forskare extremt intresserade av hela familjen av lamininer. De är en familj av [[glykoprotein]]er som är en integrerad del av den strukturella grundstommen i nästan alla djur- och människovävnader. |
| - | + | Lamininer utsöndras och inkorporeras i den [[extracellulär matrix|extracellulärar matrixen]] runt celler. Problem i produktion av laminin kan göra att musklerna formas felaktigt, vilket kan leda till en form av [[wpen:muscular dystrophy|muskeldystrofi]]. Det kan även orsaka [[progeri]]. | |
| - | + | == Uppmärksammad för sin likhet med korset == | |
| + | |||
| + | Proteinets likhet med det kristna korset har gett fenomenet omfattande uppmärksamhet på bland annat internet-bloggar, samt även bland kristna förkunnare. ''Laminin ser dock inte korsformad ut i naturligt tillstånd, formlikheten finns när dess molekylstruktur ritas upp mest eftersom dess ingående komponenter går "jämnt ut" när det ritas upp i form av ett kors.'' Lamininets form och funktion framstår som talande ljuset av bland annat följande bibelverser: [[1 Kor 12:12]], [[1 Kor 12:14|14]], [[1 Kor 12:25|25]], [[Ef 4:16]], [[Kol 1:17]], [[Kol 1:18|18]] och [[Kol 2:19|19]]. | ||
==Typer av laminin== | ==Typer av laminin== | ||
Versionen från 7 november 2008 kl. 00.05
Laminin är ett livsviktigt protein som ser till att den övergripande kroppsstrukturen hålls ihop. Mer specifikt är laminin ett protein som förekommer i det lager av protein som bildar ett underlag för alla interna organ, även kallat "basement membrane", eller den "extracellulära matrixen". Proteinet har fyra armar, som kan binda till fyra andra molekyler. De tre kortare armarna är särskilt bra på att binda till andra lamininmolekyler, vilket förklarar varför laminin är så bra på att bilda lager av proteinnätverk. Den långa armen kan binda till celler som hjälper att förankra det aktuella organet till membranet.
Laminin är den huvudsakliga icke-kollagiena komponenten i basala lamina som t.ex. det epitelceller sitter på[1], och är uppbyggt av tre separata delar, som kallas A-, B1-, och B2-kedjor. Detta ger totalt sex "ändar", som står för en stor del av dess flexibilitet i att binda till olika sorts molekyler. På grund av detta är biomaterial-forskare extremt intresserade av hela familjen av lamininer. De är en familj av glykoproteiner som är en integrerad del av den strukturella grundstommen i nästan alla djur- och människovävnader.
Lamininer utsöndras och inkorporeras i den extracellulärar matrixen runt celler. Problem i produktion av laminin kan göra att musklerna formas felaktigt, vilket kan leda till en form av muskeldystrofi. Det kan även orsaka progeri.
Innehåll |
Uppmärksammad för sin likhet med korset
Proteinets likhet med det kristna korset har gett fenomenet omfattande uppmärksamhet på bland annat internet-bloggar, samt även bland kristna förkunnare. Laminin ser dock inte korsformad ut i naturligt tillstånd, formlikheten finns när dess molekylstruktur ritas upp mest eftersom dess ingående komponenter går "jämnt ut" när det ritas upp i form av ett kors. Lamininets form och funktion framstår som talande ljuset av bland annat följande bibelverser: 1 Kor 12:12, 14, 25, Ef 4:16, Kol 1:17, 18 och 19.
Typer av laminin
Varje lamininmolekyl är en trimer, uppbyggd av alfa-, beta-, och gamma-kedjor.[2]
Man har identifierat 15 laminin trimerer.
Nätverk
Lamininer bildar ett fristående nätverk, och är associerade med typ IV kollagen-nätverk via entactin, och perlecan. De binder också till cellmembran via integrin receptorer och andra plasmamembran-molekyler, som dystroglycan glycoproteinkomplexet och Lutheran blodgrupp glykoprotein.[1] Genom dessa interaktioner, bidrar laminin på ett avgörande sätt till cellfastsättning och differentiering, cellform och rörelse, underhåll av vävnadsfenotyp, och främjandet av vävnadens överlevnad..[1][2] Vissa av dessa av laminins biologiska funktioner har kunnat kopplas till specifika aminosyrasekvenser eller fragment av laminin.[1] T.ex. , peptidsekvensen [GTFALRGDNGDNGQ], som är placerad på alfakedjan av lamininet, främjar vidhäftning av endotelceller.[3]
Patologi
Ickefunkgerande (dysfunktionell) struktur hos ett specifikt laminin, laminin-2, är orsaken till en form av congenital muscular dystrophy[4]. Laminin-2 består av en α2, en β1 och en γ1 kedja. Detta laminin förekmmer i hjärnan och i muskelfibrer. I musklerna, binder det till alfa-dystroglylan och integrin alpha7-beta1 via G domänen, och via den andra änden binder den till den extracellulära matrixen.
Referenser
- ↑ 1,0 1,1 1,2 1,3 M. A. Haralson and John R. Hassell (1995). Extracellular matrix: a practical approach. Ithaca, N.Y: IRL Press. ISBN 0-19-963220-0.
- ↑ 2,0 2,1 Colognato H, Yurchenco P (2000). "Form and function: the laminin family of heterotrimers". Dev. Dyn. 218 (2): 213–34. DOI:<213::AID-DVDY1>3.0.CO;2-R 10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R. PMID 10842354.
- ↑ Beck et al., 1999.
- ↑ Hall, TE et al (2007). Proc Natl Acad Sci USA 104 (17), 7092-7097 doi: 10.1073/pnas.0700942104