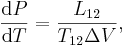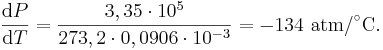Clausius–Clapeyron-ekvationen
Från Rilpedia
Clausius–Clapeyron-ekvationen uttrycker sambandet mellan tryck (P) och temperatur (T) vid en fasövergång.
där L är omvandlingsentalpin från tillstånd 1 till 2; T12 är temperaturen då övergången inträffar; ΔV = V2 – V1 är volymskillnaden mellan tillstånden. För exempelvis fasövergången vatten–is, som inträffar vid T = 0 °C och med omvandlingsentalpin L = 3,35·105 J·kg-1 samt med fasernas volymskillnad ΔV = 1,00013 (vätskefas) – 1,09070 (fast fas) = -0,0906·10-3 cm3·kg-1, förändras smältpunkten med
Det innebär att smältpunkten vid ett atmosfärtryck motsvarande 1 000 atm förskjuts till +7,5 °C. Detta är orsaken att den tunga glaciärisen rör sig eftersom i de nedre delarna utövar isen så stort tryck att vätskeform etableras.