Hemoglobin
Från Rilpedia
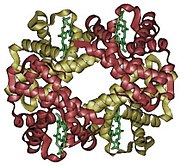
Hemoglobin, ofta förkortat Hb, är ett protein som hos människan och många andra djur står för syrgastransporten i blodet. I äldre litteratur stavas det ibland hämoglobin. Hemoglobinet transporterar syrgas från lungorna ut till kroppens övriga vävnader såsom musklerna, där hemoglobinet plockar upp avfallsprodukten koldioxid och fraktar den tillbaka till lungorna, där den lämnar kroppen.
Namnets hem kommer från hemoglobinets järninnehållande hemgrupp, som binder syrgasmolekylen och ger blodet dess röda färg, och globin syftar på själva proteinet som liksom övriga proteiner i blodet är globulärt, det vill säga mer eller mindre runt till formen. Halten av hemoglobin i blodet kan ses som ett mått på blodets förmåga till syrgastransport, och kallas blodvärde. Det finns flera sjukdomar som orsakas av mutationer i genen för hemoglobin. De vanligaste av dessa är sickle cell-anemi och thalassemi.
Innehåll |
Struktur
En funktionell hemoglobinmolekyl består av fyra subenheter, fyra separata polypeptidkedjor som binder till varandra. Var och en av dessa har en hemgrupp, en organisk molekyl som inte är ett protein, bunden till sig.
Hemgruppen består av en järnatom bunden i mitten av en struktur av kolväte, ett nätverk som kallas porfyrin. Järnatomen binder till fyra kväven i porfyrinet, som ligger i ett och samma plan och binder järnet mellan sig. Varje hemgrupp kan binda en syrgasmolekyl, så en hemoglobin-molekyl kan totalt sett binda fyra molekyler syrgas.
Det finns några olika typer av subenheter. Vuxna människor har mest det hemoglobin som kallas hemoglobin A, och består av två α- och β-subenheter. α- och β-subenheterna har liknande struktur och ungefär samma storlek, ungefär 16 000 dalton. Hela hemoglobinmolekylen väger alltså ungefär 64 000 dalton. De fyra subenheterna binder till varandra genom vätebindningar och hydrofob interaktion.
Syrgastransport
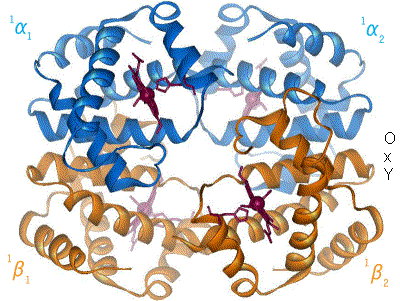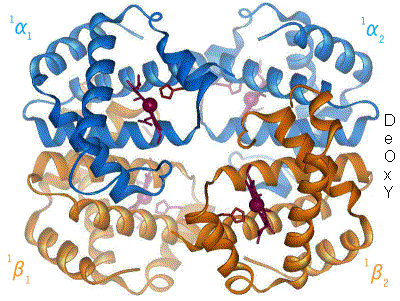
Hemoglobinet binder syrgasmolekyler i lungorna där pH är högt, alltså basiskt, och halten av koldioxid är låg, och släpper sin syrgas ute i vävnaderna, där situationen är omvänd. Den huvudsakliga mekanismen bakom detta är en konformationsförändring i globinet, alltså den del av hemoglobinet som är protein. Vid sura förhållanden blir aminosyran histidin positivt laddad. En sådan histidin ligger nära hemgruppen, och denna förändring gör att syrgasmolekylen lossnar från hemgruppen.
När syrgasmolekyler binder till normalt hemoglobin underlättar detta för flera syrgasmolekyler att binda - hemoglobinets affinitet för syrgas ökar. När syrgas binder, sker en konformationsändring hos hemoglobinet - proteinet ändrar form. De övriga av de fyra subenheterna kan då lättare binda en syrgasmolekyl till sig. Detta är orsaken till formen på den klassiska sigmoidala kurva som är resultatet om man plottar mättnadsgrad mot syrgashalt.
Kolmonoxid (CO) minskar hemoglobinets affinitet för syrgas, då kolmonoxid binder på samma plats på hemoglobinet men kolmonoxiden binder starkare; hemoglobinet har 200-250 gånger större affinitet för kolmonoxid än för syrgas. Hemoglobin som bundit kolmonoxid kallas karboxyhemoglobin och är ljusrött till färgen. Hemoglobinets stora affinitet för kolmonoxid är orsaken till att kolmonoxid är giftigt för däggdjur. Extremt höga halter kan leda till döden genom kvävning, men även små halter kolmonoxid i exempelvis cigarettrök försämrar kroppens förmåga till syrgasupptag väsentligt.
Inandningsluft som innehåller så lite som 0,02 % kolmonoxid orsakar huvudvärk och yrsel, och medvetslöshet inträffar vid ungefär 0,1 %. Hos människor som röker mycket kan upp till 20 % av de aktiva bindningsställena för syrgas vara blockerade av kolmonoxid.
Koldioxiden (CO2) däremot binder på annan plats på hemoglobinkomplexet.
För att kunna binda syrgas måste järnatomen vara tvåvärd, (Fe2+). Kvävedioxid och kväveoxid kan ändra järnatomens oxidationstal så den blir trevärd, Fe3+. Ett sådant hemoglobin kallas methemoglobin och kan inte binda syrgas.
Det ofödda fostret har en annan typ av hemoglobin, som kallas fetalt hemoglobin (Hb F, α2γ2). Fetalt hemoglobin binder starkare till syrgas än vad vanligt hemoglobin gör, vilket är viktigt för att det växande fostret ska kunna överta tillräckligt med syrgas från mammans blod.
Nedbrytning av hemoglobin
När en röd blodkropp nått slutet på sin livstid förstörs hemoglobinmolekylen och järnatomen återanvänds. Porfyrinet bryts ner i en lång kedja av reaktioner, där molekylerna i de olika mellanstegen har olika färg. Den slutgiltiga avfallsprodukten heter bilirubin, och utsöndras till gallan av levern.




