Osmos
Från Rilpedia
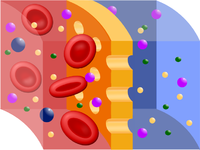
Osmos är ett fysikaliskt och kemiskt fenomen som uppstår i ett semipermeabelt membran med vätskelösning på bägge sidor.
Om membranet är genomträngligt för vätskan men inte för de salter som finns i vätskan (semipermeabelt), så kommer vätskan att strömma genom membranet till dess att osmotisk jämvikt uppstått.
Osmos är en transport av lösningsämnen som drivs av en önskan att utjämna koncentrationer mellan upplösta ämnen. Om koncentrationerna skiljer sig åt kan vätskor och lösta ämnen tränga igenom tunna hinnor av oorganiskt eller organiskt material. Osmosen kan påskyndas av elektriska fält, elektrisk endosmos.
Man kan experimentera med osmos genom att hälla vätskan eller lösningen i ett kärl, som tillslutes med den hinna (membran) som skall undersökas. Kärlet vändes så att vätskan täcker hinnans ena yta och förs ned i en annan vätska, så att denna berör hinnans andra yta. Om den yttre vätskan eller ett ämne som är löst i det tränger in i kärlet, så kallas det endosmos. Om ämne som är löst i vätskan vandrar ut ur kärlet, genom hinnan, kallas det exosmos. Exosmos användes i så kallade dialysatorer för att skilja ut kristalliserbara ämnen ur lösningar som innehåller så kallade kolloider, särskilt proteiner. Se också diffusion.
Om man sänker ned en cell eller cellsamling i en vätska med samma osmotiska tryck som cellinnehållet, så blir det ingen nettoström av vatten, vare sig in eller ut genom cellmembranen. En sådan vätska är för celler från djur, till exempel röda blodkroppar, en koksaltlösning innehållande en viss procenthalt koksalt, under en procent. Denna lösning spelar en mycket viktig roll vid fysiologiska försök och kallas fysiologisk koksaltlösning
I naturen förekommer många så kallade semipermeabla membran, det vill säga sådana skiljeväggar som släpper igenom en del av en blandning, men inte andra delar. Så släpper till exempel den levande cellens vägg igenom vatten ur en omgivande lösning, men inte koksalt som är upplöst i vattnet. Inte heller släpper det ut de i cellvätskan lösta salterna, syrorna eller proteinerna. Men i vissa fall släpper membranet ut vatten till den omgivande lösningen.
Experiment
Den tyske fysiologen Ludwig Traube lyckades åstadkomma oorganiska semipermeabla membran med liknande egenskaper, det vill säga med förmåga att släppa igenom vatten, men inte ämnen som är lösta i vattnet. För detta syfte kan man till exempel använda den hinna av ferrocyankoppar som bildas vid gränsytan mellan en lösning av ett kopparsalt (till exempel kopparvitriol) och ferrocyankalium (gult blodlutsalt). För att hinnan skall få ett stöd och kunna tåla yttre tryck, kan man fälla ut ferrocyankopparen inuti en porös lerplatta. Ett kärl vars vägg delvis består av en sådan hinna (den övriga delen består av glas eller annat ogenomträngligt material) är en artificiell cell.
Om man fyller den artificiella cellen med en lösning, exempelvis av en procent rörsocker i vatten, och sätter ned den i vatten, så strävar sockret att blanda sig med vattnet (diffusion). Men detta kan inte ske genom att sockermolekylerna går genom hinnan ut i det omgivande vattnet, för hinnan släpper inte igenom sockermolekyler, utan vattnet måste tränga in utifrån in i cellen (osmos). Nu kan man å andra sidan genom att använda tillräckligt tryck inuti cellen (som för detta ändamål är försedd med en manometer) pressa ut vatten ur sockerlösningen. Ett visst tryck (som avläses på manometern) är tillräckligt att hålla jämvikten mot vattnets inträngande, och detta kallas lösningens osmotiska tryck.
Botanisten Wilhelm Pfeffer fann på detta sätt att det osmotiska trycket för en-procentig sockerlösnings är 0,67 atmosfärer. För 2-procentig lösning är det osmotiska trycket nära dubbelt så stort. Växtfysiologen Hugo de Vries i Amsterdam och djurfysiologen Hartog Jakob Hamburger i Utrecht gjorde med hjälp av levande celler många mätningar av storleken av det osmotiska trycket hos lösningar. Ur det sålunda samlade materialet härledde Jacobus Henricus van't Hoff-lagen som säger att en lösnings osmotiska tryck är precis så stort som gastrycket av den gas, som innehåller det lösta ämnet i gasform i samma volym som lösningen intar. Denna sats ledde van't Hoff till långtgående konsekvenser, varigenom det osmotiska tryckets proportionalitet mot skillnaden mellan lösningens och lösningsmedlets fryspunkter (den så kallade fryspunktsnedsättningen) eller mellan deras kokpunkter (kokpunktshöjningen) och också mellan deras ångtryck (ångtrycksnedsättningen) fastställdes och blev huvudsatsen i hans teori, som tillsammans med den elektrolytiska dissociationsteorin bildar grunden för teorin om lösningar och som innebar stora förändringar i synen på den fysikaliska och allmänna kemin.
Även för fysiologin har den elektrolytiska dissociationsteorin haft stor betydelse, och därmed har också det osmotiska trycket varit viktigt för den fysiologiska forskningen.
Liksom gasernas tryck beror på gasmolekylernas stötar mot det omslutande kärlets väggar (kinetisk gasteori), så beror också det osmotiska trycket på stötar av lösningsmedlets och det lösta ämnets molekyler mot det för dem ogenomträngliga membranet. Det kan vara ganska svårt att mäta det osmotiska trycket, men det kan härledas ur lösningens frys- eller kokpunkt. Ur dess storlek kan molekylmassan hos det lösta ämnet beräknas vilket har stor betydelse för kemin.
Se även
- Wikimedia Commons har media som rör Osmos
- Osmotrofi
- Osmotisk potential
 Denna artikel är helt eller delvis baserad på material från Nordisk familjebok, 1904–1926 (Not).
Denna artikel är helt eller delvis baserad på material från Nordisk familjebok, 1904–1926 (Not).