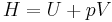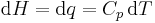Entalpi
Från Rilpedia
Entalpi är summan av den inre energin och produkten av trycket och dess volym. Detta skrivs vanligen som:
där H står för entalpi, U för inre energi, P för tryck och V för volym. Entalpin kan precis som den interna energin inte mätas direkt - det är endast meningsfullt att räkna på relativa entalpier ΔH = H − Href.
Entalpi har införts därför att det är en bekväm storhet att arbeta med vid konstanta tryck. Då gäller
där den sista likheten gäller i frånvaro av fasövergångar. Ändringen i entalpi är alltså lika med den tillförda värmemängden.
Bildningsentalpi anger den mängd entalpi som behöver tillföras för att bilda en förening från dess grundläggande beståndsdelar. Bildningsentalpin kan fås genom att bindningsentalpierna för föreningen adderas ihop.
Smältentalpi anger den mängd entalpi som behövs för att få ett ämne att gå från fast till flytande fas, analogt med Ångbildningsentalpi, som talar om hur mycket entalpi som behöver tillföras för att ämnet skall gå från flytande- till gasfas.
Förbränningsentalpi är den värmemängd som utvecklas när en mol av ett ämne förbränns i syre vid konstant tryck.
Ett väldigt förenklat exempel är is. Is kräver tillförsel av entalpi (kanske i form av värme) för att bryta upp bindingarna mellan vattenmolekylerna. Faktum är att det paradoxalt nog är "bekvämast" för vattnet att vara i isform vid temperaturer under fryspunkten.
En process i vilken entalpin är konstant kallas isentalpisk.