Brownsk rörelse
Från Rilpedia
Brownsk rörelse, slumpvandring eller random walk är namnet på den slumpmässiga rörelse som främst kan iakttas hos mycket små partiklar som svävar i en fluid (fysikaliskt begrepp som motsvarar vätska eller gas). De första studierna av det som idag kallas Brownsk rörelse företogs av biologen och botanikern Robert Brown 1827; den förste som lyckades förklara fenomenet var Albert Einstein 1905.
Rörelserna hos partiklarna är slumpmässiga och har en fraktal karaktär. Om man mäter en partikels position med jämna mellanrum har rörelsen samma sick-sack-utseende oberoende av med vilket tidsintervall mätningen görs.
Rörelsen uppkommer hos partiklar som är så små att det finns en markant sannolikhet för att mycket färre molekyler från omgivningen stöter emot partikelns ena sida, än på motsatt sida. Resultatet blir att partikeln får en "knuff" i riktning mot det lägre antalet molekyler. Denna förklaring av den Brownska rörelsen blev det som slutligen fick forskarvärlden att acceptera atomteorin i dess moderna tappning.
Innehåll |
Historik
Jan Ingenhousz hade visserligen år 1765 observerat att kolpartiklar i alkohol rör sig slumpmässigt, men Robert Brown räknas ändå som den Brownska rörelsens upptäckare. 1827 iakttog han att pollen som var suspenderade (uppslammade) i vatten rörde sig på ett kaotiskt sätt. Den rådande teorin var att partiklarna var "primitiva levande molekyler", men då han fann att fenomenet även kunde ses vid tester med ickeorganiska ämnen så övergavs så småningom den förklaringen. Ett första steg mot en modernt accepterad förklaring dröjde till 1877 då Delasaux hävdade att partiklarnas oregelbundna rörelser orsakades av kollisioner med snabba vätskemolekyler. Senare visar Guoy att effektens storlek, det vill säga hur långt en partikel rör sig mellan två riktningsändringar, beror på vätskans viskositet och temperatur.
Thorvald N. Thiele blev 1880 den första att studera matematiken bakom Brownsk rörelse i en uppsats om minsta kvadrat-metoden. Oberoende av hans arbete studerade Louis Bachelier samma sak i sin doktorsavhandling Théorie de la spéculation ("Teori om spekulation"), som egentligen behandlade stokastisk analys av aktie- och optionsmarknaden.
1905 blev Einstein den som lyckades förklara den Brownska rörelsen. Tillsammans med Marian Smoluchowski visade han att den kinetiska teorin för vätskemolekyler liknade den kinetiska teorin för gasmolekyler, och att partiklarnas diffusion lydde samma lagar som den omgivande vätskan.
The Svedberg gjorde viktiga experiment med Brownsk rörelse i kolloider och Felix Ehrenshaft visade att även silverpartiklar i luft betedde sig på samma sätt. Jean Perrin gjorde experiment som bekräftade de nya matematiska modellerna, och hans resultat bilade slutligen den 2000 år gamla debatten angående atomteorin.
Ungefär 40 år senare visades att en Brownsk rörelse har fraktal dimension (även kallad Hausdorffdimension) 2. Det är alltså nästan säkert att en partikel som bara rör sig i ett tvådimensionellt plan kommer att återvända till utgångspunkten någon gång. (Att det är nästan säkert betyder att sannolikheten för att partikeln inte ska passera en given punkt – exempelvis en punkt den har befunnit sig i förut – går mot noll då tiden går mot oändligheten).
Fysikalisk beskrivning
Einstein visade att den genomsnittliga sträckan  en partikel förflyttar sig under tiden
en partikel förflyttar sig under tiden 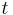 i en vätska med diffusionskonstant
i en vätska med diffusionskonstant  ges av
ges av
Den klassiska termodynamikens lagar säger vidare att
där de storheter som ingår är allmänna gaskonstanten  , temperaturen
, temperaturen  , vätskans viskositet
, vätskans viskositet  , Avogadros tal
, Avogadros tal  och partikelns radie
och partikelns radie  . Detta ger en möjlighet att beräkna ett närmevärde av Avogadros tal, vilket också gjordes ett par år efter Einsteins beräkningar.
. Detta ger en möjlighet att beräkna ett närmevärde av Avogadros tal, vilket också gjordes ett par år efter Einsteins beräkningar.
Under vissa förhållanden – mycket låga temperaturer – gäller inte ovanstående samband för  , då detta inte tar hänsyn till den nollpunktsrörelse hos vätskans partiklar som Heisenbergs osäkerhetsprincip kräver.
, då detta inte tar hänsyn till den nollpunktsrörelse hos vätskans partiklar som Heisenbergs osäkerhetsprincip kräver.
Matematisk modell
Den matematiska modell som brukar användas för att beskriva brownsk rörelse är en så kallad Wienerprocess. Den baserar sig på att sannolikheten för att en partikel som vid tiden t befinner sig i punkten (x, y, z) får en slumpmässig hastighet i någon riktning, och där denna slumphastighet beskrivs av en normalfördelning. I varje riktning (vi kan anta x-riktningen) har denna normalfördelning ett medelvärde  och en varians
och en varians  . Vektorn
. Vektorn  kallas drifthastigheten, och kan exempelvis orsakas av gravitationen eller strömmar i vätskan.
kallas drifthastigheten, och kan exempelvis orsakas av gravitationen eller strömmar i vätskan.
Litteratur
- Andrei N Borodin och Paavo Salminen, Handbook of Brownian motion—facts and formulae, Birkhäuser Verlag 2002, ISBN 3-7643-6705-9.
- Edward Nelson, Dynamical theories of Brownian motion, Princeton Univerity Press 1967, ISBN 0-691-07950-1. (PDF-version av en bok som gått ur tryck.)
- Zur Erkenntnis der Kolloide. Jena, G. Fischer, 1905; 2:a utgåvan 1919, Richard Adolf Zsigmondy.
- Lehrbuch der Kolloidchemie, Richard Adolf Zsigmondy.
- Kolloidforschung in Einzeldarstellungen, Richard Adolf Zsigmondy.
- Das kolloide Gold. With P. A. Thiessen. Leipzig, Akademische Verlagsgesellschaft, 1925, Richard Adolf Zsigmondy.
- Colloids and the Ultramicroscope: A Manual of Colloid Chemistry and Ultramicroscopy. New York, Richard Adolf Zsigmondy.
- Über Kolloidchemie. Leipzig, 1907. 5:e utgåvan i två volymer 1925-1927, Richard Adolf Zsigmondy.
- Studien zur Lehre von den kolloiden Lösungen (1907; doktorsavhandling), The Svedberg
- Die Existenz der Moleküle (1912), The Svedberg
- Materien (1912), The Svedberg
Källor
- Delar av artikeln är översatta från engelska Wikipedia den 1 augusti 2006
Se även
- Geometrisk Brownsk rörelse
- Fraktal dimension
- Norbert Wiener
- Wienerprocess
- Fysikalisk konstant
- Vitt brus
- Brunt brus
Externa länkar
- http://abel.math.umu.se/fo_info/brown/ En simulering + förklaring från Umeå univresitet.





