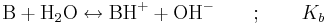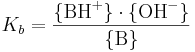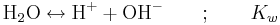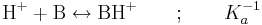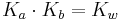Baskonstant
Från Rilpedia
En baskonstant Kb är en typ av kemisk jämviktskonstant som anger styrkan av en bas. För starka baser, till exempel natriumhydroxid, NaOH, är baskonstanten ganska ointressant eftersom dessa dissocierar fullständigt under normala förhållanden. Med andra ord behövs ingen baskonstant för att beskriva relationen mellan basen och produkterna i reaktionen. Baskonstanten är relevantare för svaga baser. Två exempel på sådana är ammoniak (NH3) och vätekarbonatjon (HCO3-).
Definition
Då en svag bas, betecknad med B, reagerar med vatten produceras hydroxidjoner. Reaktionen kan skrivas på följande sätt:
Baskonstanten Kb definieras på följande sätt (se vidare under jämviktskonstant):
Här har aktiviteten för vatten (H2O) försvunnit ur uttrycket eftersom den sätts till 1 enligt konvention.
Baskonstanten används dock sällan i verkligheten för att beskriva styrkan av en bas. Detta beror på att varje bas står i jämvikt med en syra (BH+ i ovanstående ekvationer), och att styrkan hos den syran styrs av dess syrakonstant. Relationen mellan baskonstanten och syrakonstanten ges av vattnets autoprotolys:
Kombinerar man ihop vattnets autoprotolys med basens reaktion får man:
det vill säga baklängesreaktionen för den korresponderande syran BH+. Vi får även att:
Alltså kan baskonstanten beräknas från den korresponderande syrans syrakonstant och vattnets autoprotolys. Ofta används endast syrakonstanten för att beskriva ett syra-baspar eftersom {H+}, till skillnad från {OH-}, är mätbar genom pH-värdet.