Redox
Från Rilpedia
Redox är det kemiska fenomen vid vilket oxidationstalen hos atomer förändras. Vanligtvis sker detta genom att en eller flera elektroner förflyttas från en atom till en annan.
- Oxidation är det fenomen varvid en atom, molekyl eller jon förlorar en eller flera elektroner. Oxidationstalet stiger.
- Reduktion är det fenomen varvid en atom, molekyl eller jon tar emot en eller flera elektroner. Oxidationstalet sjunker.
Vid en redoxreaktion sker alltså en reduktion och en oxidation samtidigt. Eftersom laddningar hos joner och atomer i en reaktion är detsamma före reaktionen som efter och eftersom elektroner ogillar att vara i fritt tillstånd, så sker det alltid en reduktion samtidigt som en oxidation, och vice versa. Notera att redox-reaktioner kan gå åt bägge håll, beroende på både pE-värdet och pH-värdet.
Ett ämne som får ett annat ämne att oxidera kallas oxidationsmedel. Ett ämne som får ett annat att reduceras kallas reduktionsmedel eller elektrondonator.
I vardagligt språkbruk avses med oxidering ofta en process där ett ämne reagerar med syre. Syre är också ett mycket vanligt oxidationsmedel, men redoxreaktioner kan naturligtvis ske utan syre.
Exempel på redoxreaktion
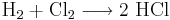
Cl2 är väldigt elektronegativt och kommer därför orsaka vätets oxidation, klor är ett oxidationsmedel. Klor reduceras av vätet (som är ett reduktionsmedel; det orsakar att Cl2 tar upp de två elektronerna som vätet avger).



